品質づくり、このような希望はありませんか?
- 規制当局の査察に備えたい
- 品質システムの構築/改善を具体的に進められるパートナーがほしい
- 製造施設に潜む問題やリスクに対する不安を払拭したい
- 外部委託先の製造工場や原材料供給元の監査を担当する人材がほしい
- 新規参入分野での品質システムを効率よく立ち上げたい

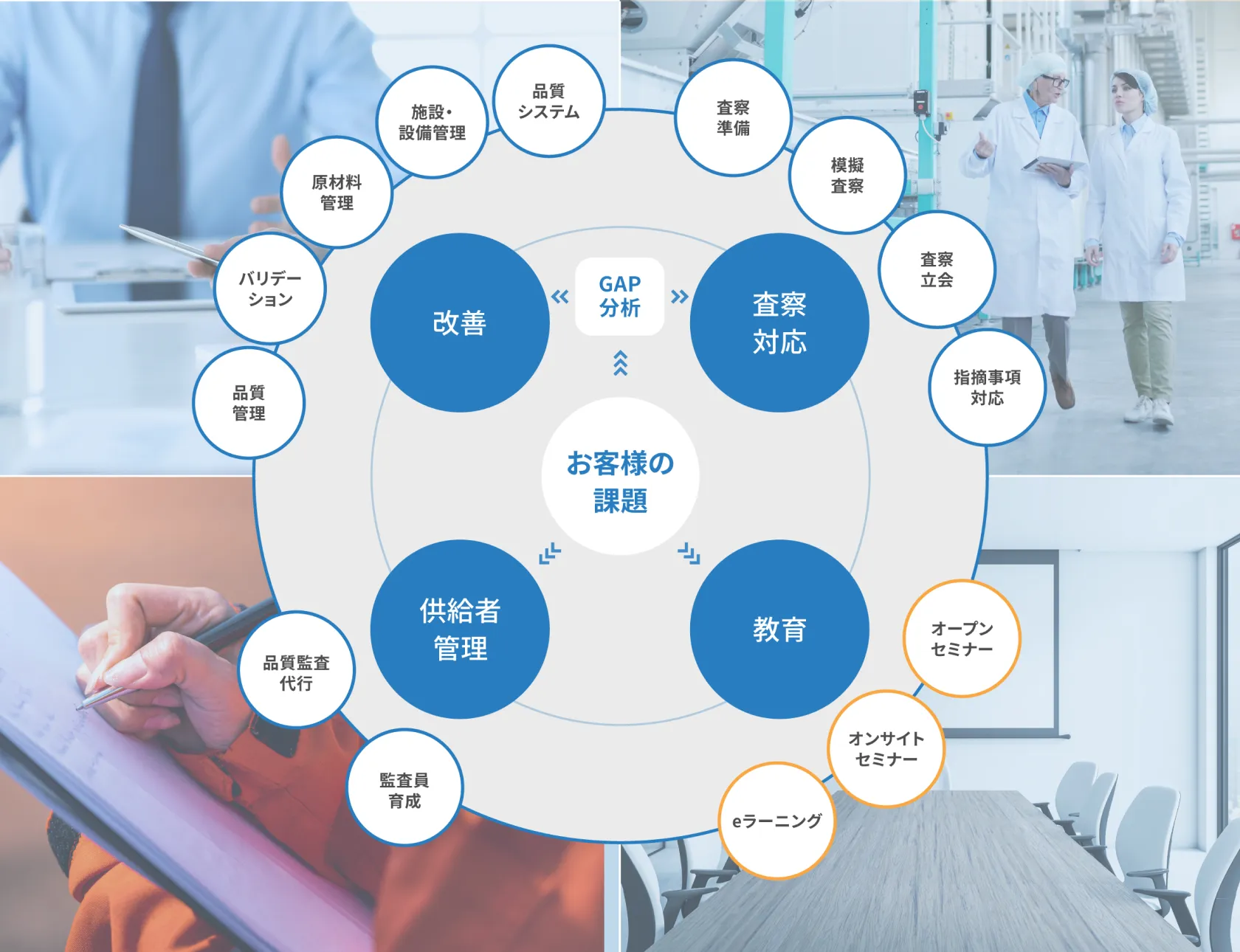
シーエムプラスのGMDPコンサルティングなら
- FDA、PMDAなど規制当局査察に対し、以下の支援が可能です。
- 模擬査察
- 査察対応者トレーニング
- 査察時バックヤードでの支援
- 指摘事項回答支援
- 指摘に対する改善支援
- 海外監査等での通訳
- PQSの構築や改善、原材料の保管管理や施設の導線改善、現場の運用改善などに関する改善提案を総合的な視点で行います。社内にエンジニアリングのコンサルタントがいるため、施設の改善提案がスムーズにできることも強みです。
- GAP分析を実施することにより、まずは製造所の「現実の姿」と「今後の望ましい姿」との差異
(ギャップ)を明確にします。設備・施設と品質システムの両面から、隠れたリスクを含めた課題を洗い出し、改善提案を行います。 - 経験豊富なコンサルタントが品質監査を代行します。
- GMP Auditor(監査者)を育成します。
- 多くの経験に基づき、人員規模など状況に応じた品質システム構築、手順書作成を支援いたします。 また、薬事やバリデーションの専門家がいるシーエムプラスではこれらのご相談もワンストップでお受けすることができます。
国内外から結集したトップコンサルタントがGMDP改善コンサルティングで品質づくりを支えます。
改善支援
A:医薬品品質システム構築/改善支援
医薬品の品質を支え、以下のBからEのすべての活動に関連する製造管理/品質管理について、「PIC/S GMP Guide Part I / II」等に沿った構築と継続的改善を支援します。品質方針を基盤とするSOPの文書体系のあるべき姿をご提案し、製造現場の品質を支える手順書・記録書の整備を支援します。
B:施設・設備システム改善提案
レイアウト、清浄度ゾーニング、人・物の動線をGMPの観点でレビューし、改善対策を提案します。また、「PIC/S GMP Guide Annex11」等の最新動向に沿ったCSVコンサルティングを提供します。
C:原材料管理システム構築/改善支援
供給業者の選定や管理、原材料・中間製品・製品を保管する倉庫の管理、倉庫への搬入と倉庫からの搬出の管理、配送などについて、改善方法をご提案します。
D:試験室管理システム構築/改善支援
検体・標準品・試薬の管理、試験室や試験機器の適格性評価・保全・校正、分析法バリデーション、データインテグリティの確保などにつき、試験室管理全般のシステム構築や改善を支援します。
E:バリデーション活動支援
2011年の「FDA Guidance」や2015年改正の「PIC/S GMP Guide Annex15」などにより、プロセスバリデーションの概念が大きく変化し、製品ライフサイクルを通じた継続的活動と位置づけられるようになりました。製品開発時に集積された根拠データから適正なトレーサビリティーが取れるように、お客様のCMCデータをレビューし、有効なアプローチをご提案します。また、洗浄バリデーション、分析法バリデーション、CSVなど様々なバリデーション、製品品質の照査を基盤とする継続的改善への展開を支援します。
-
製造施設・建築設備のバリデーションはこちらをご覧ください。
査察対応支援
規制当局の元査察官や、日米欧の査察経験者による模擬査察を行い、お客様の査察準備状況に応じた適切な指導・改善提案を行います。また、査察時のバックヤード支援や査察での指摘事項の対応支援を行います。
- 元査察官/査察経験者による模擬査察(査察と同じ進め方によるシミュレーション体験)
- 現状のGMP査察対応力分析と改善提案
- 査察対応者のためのトレーニング
- 各種ドキュメント作成および規制当局とのミーティング支援
※米国FDAの例:プレミーティング(Type C Meeting)のパッケージ作成支援、ミーティングアテンド支援 - 査察時にバックヤードで資料の準備や回答へのアドバイス
- 査察での指摘事項への改善計画の立案や回答書の作成支援
GMDP教育訓練支援
医薬品の生産活動には、効果的なGMDP教育を継続的に実施し、GMDPを正しく理解した人材を育成することが重要です。CM Plusでは個人のレベルを向上させる「eラーニング」、「オープンセミナー」と、組織全体のレベルを向上させる「オンサイトセミナー」を提供しています。
eラーニング、オープンセミナー、オンサイトセミナーにつきましては、
こちらの『教育訓練支援』をご覧ください。
以下のリンクは弊社運営のGMP Platformのリンクとなります。
供給者管理支援
経験豊富なコンサルタントにより、品質監査(Quality Audit)業務に関する支援を行います。
原薬・製剤の製造業者の他、原料や資材供給業者への監査にも対応いたします。
A:国内・海外の品質監査の実施支援および品質監査の代行
お客様と一緒に、またはお客様の代わりとして、製造委託先、原料や資材の供給者などの品質監査を行います。国内外の豊富なコンサルティング経験を持つエキスパートが対応いたします。国内製造所のほか、海外製造所への監査にも対応します。
B:Auditor(監査者)育成支援
初心者や初任者および育成担当者のための教育研修をご提供し、Auditorの育成及び社内認定を支援します。
監査人員の不足にお悩みの企業様向けに弊社で実施しているGMP監査者育成用セミナー「Auditor育成プログラム」は、ご好評をいただき定期的に開催しております。経験豊かな講師が作成したオリジナルの体系的な教材を使用し、限りなく実地に近い状況を想定した演習(ロールプレイング)も行います。
Auditor育成プログラムにつきましては、こちらの『教育訓練支援』をご覧ください。
以下は弊社運営のGMP Platformのリンクとなります。
その他のサービス
A:治験薬GMP
創薬ベンチャー企業などが対象化合物を開発ステージへ進める段階において、治験薬製造を全面的に外部へ委託する場合も含めて、治験薬GMP体制の構築やSOP整備につき支援を行います。
B:GQP業務支援
日本独自の規制であるGQP省令に関して、経験豊富なコンサルタントがGQP体制の整備やSOP改善につき支援を行います。
コンサルティング実施までの基本的な流れ
オンラインや訪問による打合せ
ご要望をお聞きした上で、ご提供できるサービスをご紹介します。お伺いした内容を盛り込み、後日見積書と見積仕様書をご提示します。必要に応じて、打合せの前に守秘契約を締結します。
発注・契約
ご提示させていただいたサービス・見積条件でご発注いただける場合は、①守秘契約を締結して発注書を発行していただくか、②守秘を含む業務委受託契約を締結させていただきます。
コンサルティング実施
GAP分析、改善支援、監査代行などの実際のコンサルティングを現地訪問やオンラインにより実施します。
業務報告書などの提出
お客様との合意に基づき、コンサルティング記録や監査報告書などを提出します。