医療機器業界への新規参入支援
世界の医療機器の市場規模は約30兆円と推定され、日本国内だけでも約2.8兆円といわれています。
市場規模が大きく、新規参入に魅力的な市場ですが、医療機器は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(略称:医薬品医療機器等法または薬機法)による厳しい規制があります。ある素材や技術が医療に応用できるものであっても、それを医療機器として世に送り出すためには、越えなければならない高いハードルがあります。
シーエムプラスは、医療機器の計画当初からQMS省令(ISO 13485)に基づく品質マネジメントシステムの構築、品質マネジメントシステムに基づく製品の設計開発を実施し、後戻りのない新規参入を支援します。
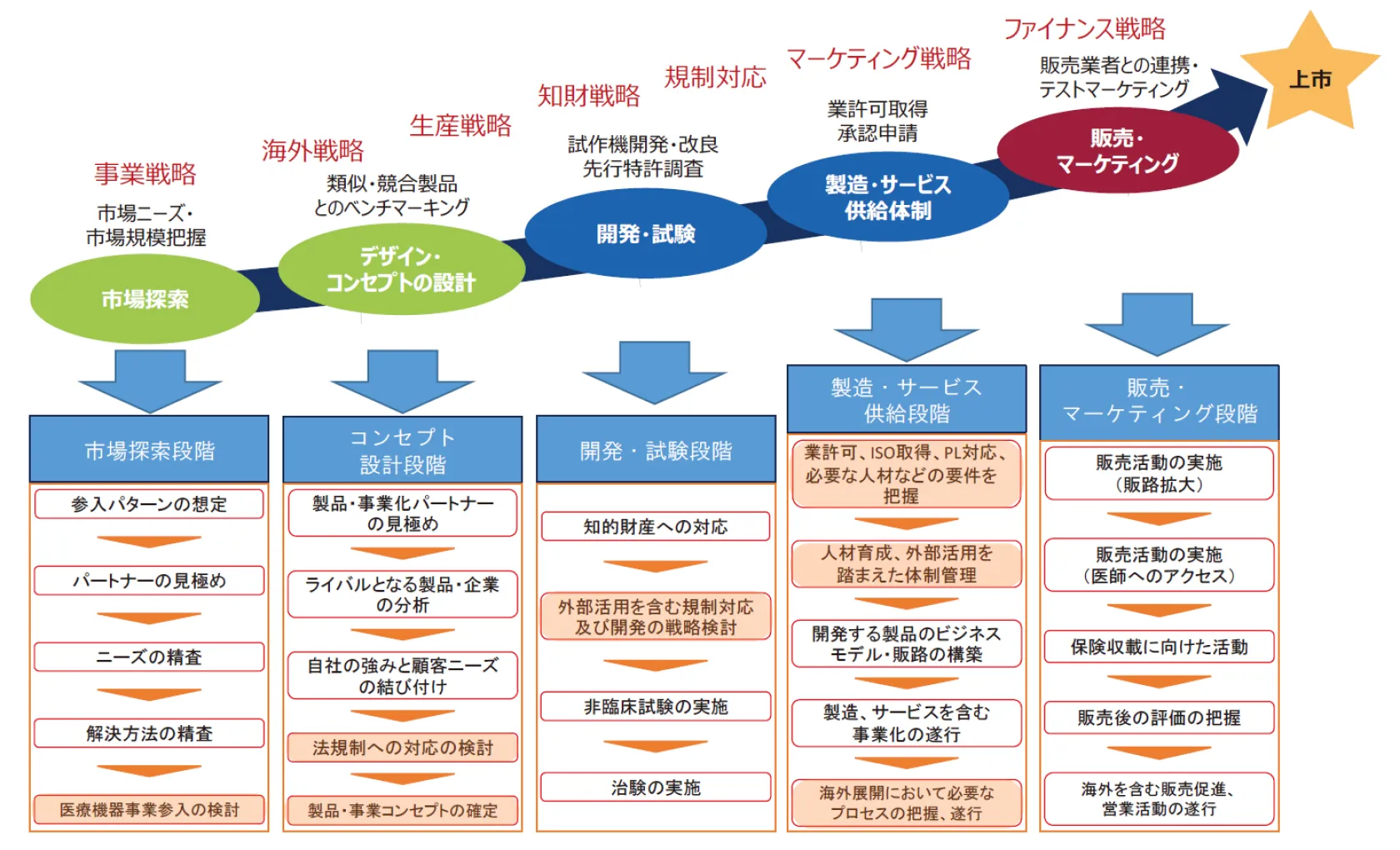
医療機器の開発から
上市までのロードマップ
「医療機器開発支援ハンドブック」令和5年10月改訂
内閣官房(健康・医療戦略室)・文部科学省・厚生労働省・経済産業省 より
※はシーエムプラスの医療機器コンサルティングサービスの範囲を示します。
国内における進行ステップ事例
 製造販売業の取得および製造業の登録
製造販売業の取得および製造業の登録
国内医療機器の製造販売は医薬品医療機器等法に従う必要があります。
製造販売を行うためには製造販売業の取得が、また製造を行うためには製造業の登録が必要となります。
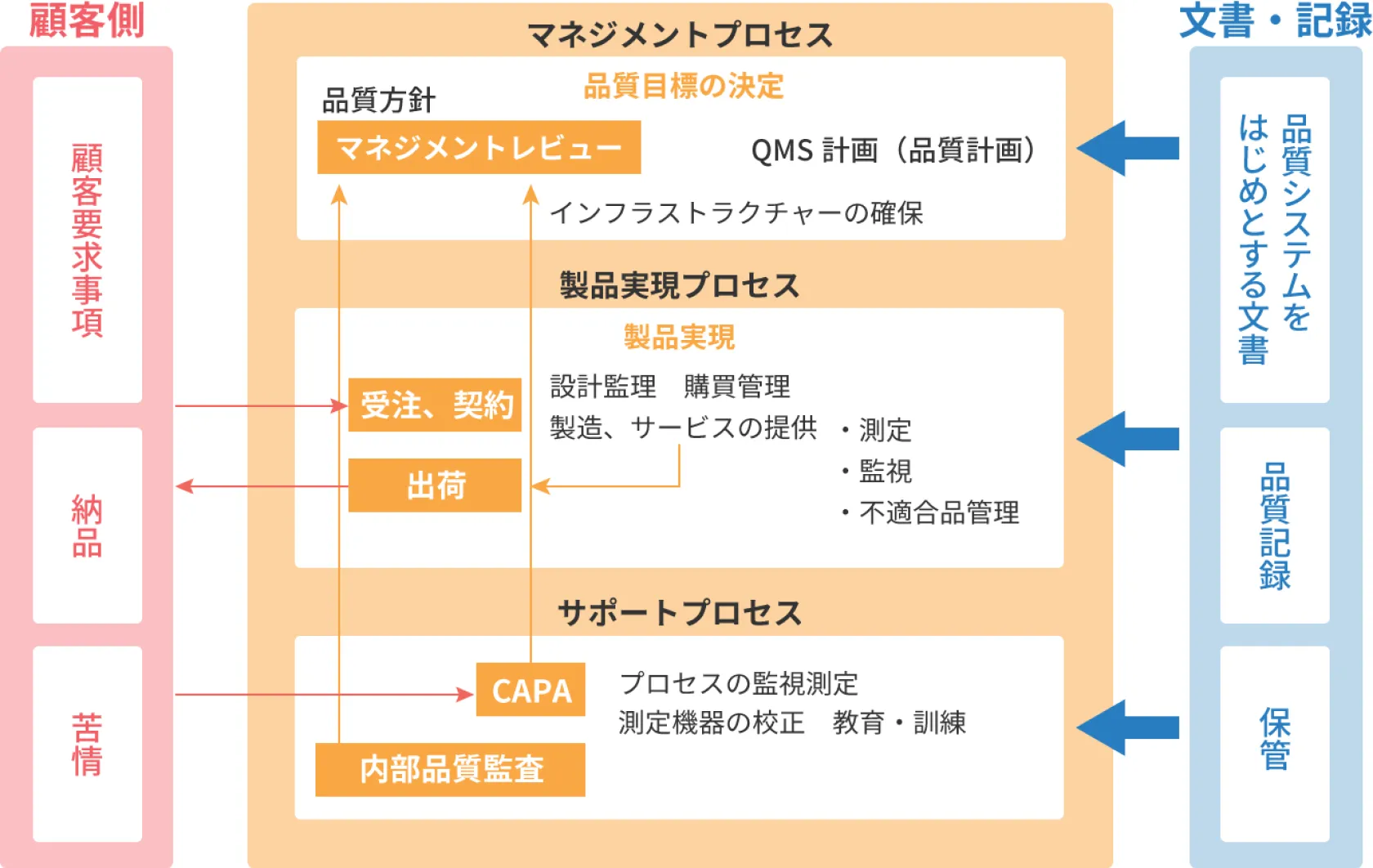
 QMS(品質マネジメントシステム)の構築
QMS(品質マネジメントシステム)の構築
医療機器の一連の設計開発~製造~出荷~販売を行うためには品質マネジメントシステム(Quality Management System:QMS) が必要になり、まずQMS を構築します。
これは国内では厚労省令169号(QMS省令)に定められています。この169号は ISO13485(2016版)とほぼ同一の内容になります。
 医療機器の届出、認証申請、承認申請
医療機器の届出、認証申請、承認申請
製品の設計開発、製造の準備ができたら、医療機器の届出、認証申請、承認申請が必要になります。どれを選択するかはその医療機器のもつリスクの度合いによって決まります。
例えば針のついていない注射器は届出ですが、針のついた注射器は認証申請になります。
そして、血管に挿入するカテーテルなどは承認申請が必要になります。
 QMS 適合性調査
QMS 適合性調査
認証申請、承認申請の場合は申請後、確かにQMS 省令や ISO13485(2016版)に則って製造管理、品質管理などが実施できる状態にあるかどうかの QMS 適合性調査が実施されます。これは認証の場合は登録認証機関によって、承認品の場合は PMDA(医薬品医療機器総合機構)によって実施されます。
 製造販売
製造販売
認証と承認の申請の場合、申請書の審査に適合し、このQMS適合性調査に合格して初めて製造販売が可能となります。
シーエムプラスの新規参入支援サービス
上記の事例のように、新規参入へのステップの中では規制要求事項に基づき、様々な業務が発生します。CM Plusは、これらの業務遂行を支援いたします。プロジェクト全体の支援はもちろん、例えばバリデーションのみといった部分的な支援まで、お客様が必要とするサービスを提供いたします。具体的な支援内容は以下の通りです。
QMS 構築
品質マネジメントシステムの構築のために必要となる文書策定のサポート、実際の運用のサポートなど規模に応じた、かつできるだけコンパクトなQMSを構築するお手伝いをします。

設計管理の支援
新規に開発する医療機器の設計にあたり、要求事項の明確化~インプットへの変換~実際の設計開発作業の進め方~アウトプット作成~アウトプットの検証~アウトプットのバリデーション、また要所要所でのリスクマネジメントなどの作業のお手伝いをします。

QMS 適合性調査の準備の支援
認証機関やPMDAの査察の事前準備のお手伝いや模擬査察などのサービスを提供します。

バリデーション支援
製造所に製造工程を設営するにあたり、実施するバリデーションの計画から報告書の取りまとめ方など全般のサポートを実施します。

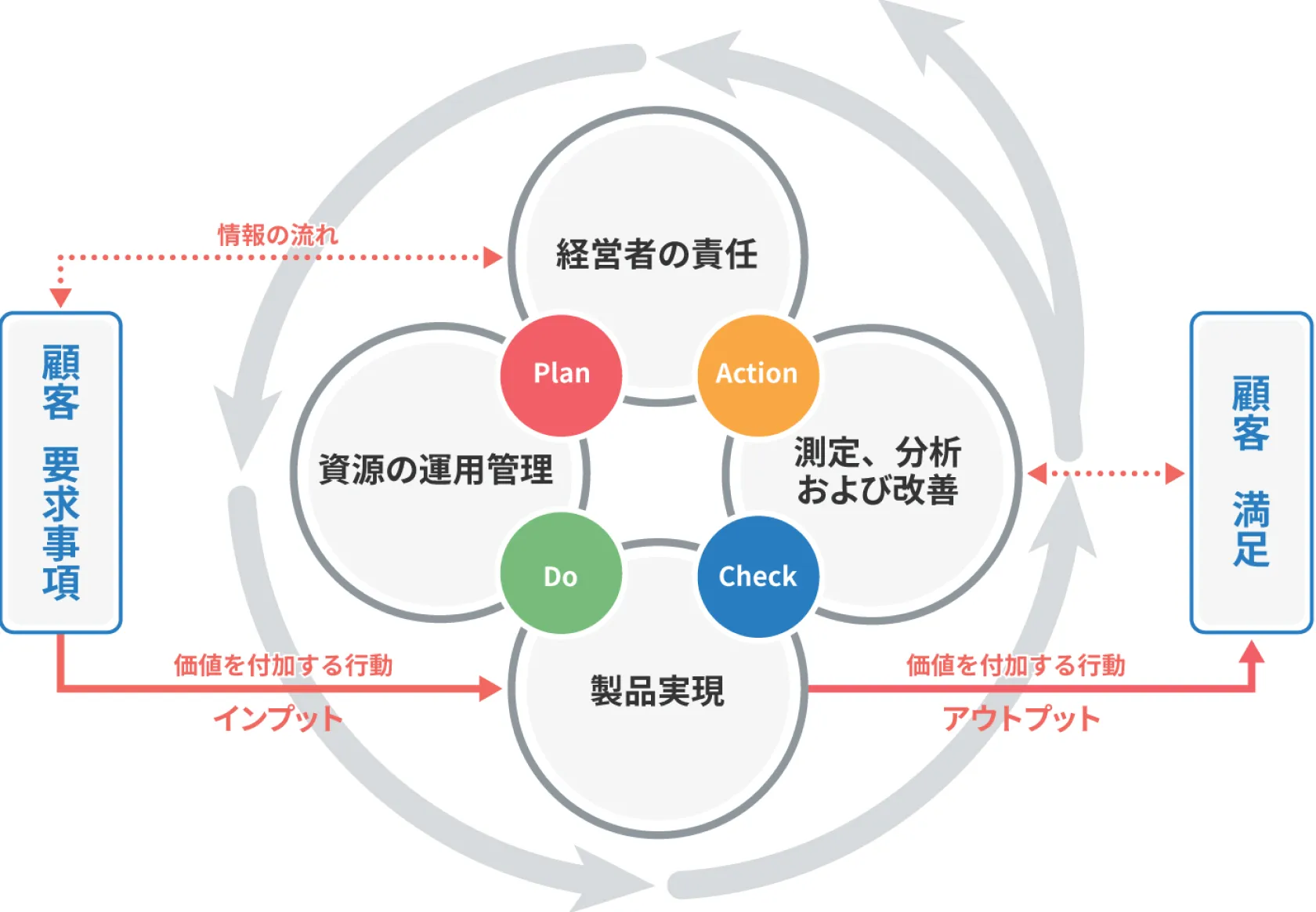
品質マネジメントシステム:QMSの継続的改善
医療機器は、治療や診断のための道具であるため、改善、改良といった継続的な性能の向上、安全性の向上、そして品質マネジメントシステム (QMS) そのものの継続的改善も求められます。この継続的改善をお手伝いするために、CM Plusは以下のサービスを提供します。
また、医療機器メーカーの多くは国内市場のみならず世界各国へ輸出をしています。規制要求事項も日本国内のQMS 省令のみならず、国際標準規格のISO13485、米国FDAのQSR(Quality System Regulation)など様々なものがあり、輸出に当たっては輸出先の規制に適合しなければなりません。
品質マネジメントシステムの継続的改善
品質マネジメントシステム(QMS)の最適化
過去のISO13485の定期監査の指摘事項の修正を重ねていくうちに品質マネジメントシステム自体が肥大化し、重く運用しづらく、書類の山ばかりとなってしまうケースをよく見受けます。
生産施設の規模や製造販売する品目の数に応じ、PDCAをベースとしたコンパクトで運用しやすい品質マネジメントシステムの再構築を支援します。
マネジメントレビューのシステム構築支援
QMSの心臓部は経営層が直接関与するマネジメントレビューです。
マネジメントレビューの内容の最適化やその様式など具体的に検討し、経営層が判断しやすい仕組みづくりをお手伝いします。
是正処置、予防処置システム見直しの支援
外部からのQMS監査で最も指摘の多いのが是正処置と予防処置に関するものです。
真の是正処置とは? 効果的な予防処置の手法とは? このような観点から現行のシステムの見直しを提案します。
設計管理支援
新規に開発する医療機器の設計にあたり、
- 要求事項の明確化
- インプットへの変換
- 実際の設計開発作業の進め方
- アウトプット作成
- アウトプットの検証
- アウトプットのバリデーション
- 重要ポイントでのリスクマネジメント
をお手伝いします。
また、PDCA に基づくプロトコルの作成から報告書の作成まで文書全般にわたってサポートします。
CSV(コンピュータ化システムバリデーション)支援
医療機器そのものへのソフトの組込み、ソフト単体での販売、品質マネジメントシステムでの特別なソフトウェアの使用など、現在ではCSV(Computerized System Validation)は避けて通ることはできません。このCSV のプランニングからレポート作成までのプロセスのお手伝いをいたします。
QMS 適合性調査の準備の支援
認証機関やPMDAによるQMS適合性調査の事前準備のお手伝いや模擬監査などのサービスを提供します。
バリデーション支援
生産施設に製造工程を設営するにあたり、実施するバリデーションの計画から報告書の取りまとめ方など全般のサポートを実施します。特に滅菌工程に関しては関連ユーティリティのバリデーションを含めて対応するサービスの提供を行うことができます。
製造施設・建築設備のバリデーションはこちらをご覧ください。
コンビネーションプロダクト コンサルティング
シーエムプラスは医薬品コンサルティングも提供しており、コンビネーションプロダクト(医薬品+医療機器)についても対応可能です。

シーエムプラスにお気軽にご相談ください。
シーエムプラスでは様々な分野のコンサルタントが在籍しており、お客様のニーズに合わせてサービスのカスタマイズが可能です。お気軽にご相談ください。
eラーニングサービスのご案内
「ISO 13485:2016 対応 医療機器 QMS 実践コース」
Web ベースでの ISO13485 の教育訓練の提供も行っています。
医療機器 QMS 実践コースのポイント
2016年版、ISO 13485の改訂に対応し、ISO13485が求める基本を押さえつつ、“2016年に改訂された規制の変更点”と、“具体的に実践すること”の両面から解説します。
品質マネジメントシステムのプロセス概念図
『品質マネジメントシステムのプロセス概要図についての解説』
(e ラーニング「ISO 13485:2016 対応 医療機器 QMS 実践コース」内、講座 2 品質マネジメントシステム より抜粋)