| 分 類 名 称 |
低分子 | 中分子 | 高分子 |
|---|---|---|---|
| 分 子 量 |
|
|
|
| 例 |
|
|
|
| 主 な 製 造 方 法 |
|
|
|
高分子原薬は主に微生物培養原薬と動物細胞培養原薬があり、遺伝子組み換えやセルバンク、細胞培養、抽出、精製などの技術を組合せてタンパク質の有効成分を生産する。抗体、酵素、ホルモン、インターフェロン等が代表的な例となる。低分子医薬品では難しかったアンメット・メティカルニーズへの対応が期待される。生物やタンパク質を取り扱うため、製造設備の無菌性の確保や環境条件の生物学的な取り扱いが必要となる。
高分子原薬の種類と特徴
高分子(バイオ)医薬品に用いられる素材と主要な医薬品
| 素材 | 主な医薬品 | ||
|---|---|---|---|
| 宿主細胞 | 動物細胞 | CHO、 SP2/0、 NS0、ヒト細胞 (HT1080,HEK)等 |
|
| 微生物 | 大腸菌 |
|
|
| 酵素 |
|
||
| 昆虫細胞 |
|
||
| 植物細胞 | イネ、タバコ、人参 |
|
|
| 由来細胞 | 動物 |
|
|
| 植物 |
|
||
| 血漿 |
|
||
微生物培養原薬
微生物培養は自然界に存在する微生物を利用したものと、遺伝子組み換え微生物によるものとに分けられる。遺伝子組み換え微生物によるものは大腸菌や酵母などの微生物に目的物質(原薬となる物質)をコードする遺伝子を組み込み、その微生物に目的物資を生産(発現)させて、精製する方法により生産する。遺伝子組み換え微生物を取り扱う場合はバイオセーフティーに関するカルタヘナ法の適用を受ける。微生物は比較的取り扱いが簡単で大量培養も容易だが、活性を保った形で目的物質を発現させるのが難しく、シンプルな構造の低分子量タンパク質の生産に適している。
動物細胞培養原薬
微生物培養原薬と同様に組み換えDNA技術を用いるが、CHO細胞やCOS細胞などの動物細胞を宿主として薬効物質を発現させて、精製する方法により生産する原薬のこと。糖鎖などの修飾を受けるタンパク質や複雑なサブユニット構造をもつ高分子量のタンパク質の生産に向く。動物細胞は微生物に比べて取り扱いが難しく培養には高度な制御が必要となるが、発現させた物質について、立体構造や糖鎖の付加など天然型に近い活性型で得られる。微生物培養と比較して、一般的には1バッチの製造に必要な期間が長く、高価な培地や精製用のクロマトグラフィーレジンを必要とする。
ワクチン
ワクチンは体内に病原体に対する免疫を作るための製剤であり、その製造は国に定められた機関のみで行われ、出荷に際しては国家検定に合格することが求められる。ワクチンには大きく生ワクチンと不活化ワクチンの2種類があり、不活化ワクチンは生ワクチンより安全性が高いが、ワクチンとしての効果が低い為、アジュバンドと呼ばれる添加剤を入れて効果を促進させる必要がある。
血液製剤
血液製剤は人の血液に含まれる有効成分を使用した医薬品で、輸血用血液製剤と血漿分画製剤で構成される。輸血用血液剤は全血、または赤血球、血小板、血漿などの成分を分離、調整した成分製剤のこと。血漿分画製剤は血漿中のタンパク質を分離・精製したもので、アルブミン製剤、免疫グロブリン製剤、血液凝固因子製剤、希少疾患製剤などがある。原料となる血液はすべて献血により日本赤十字社を通じて国内製造3社に配分されている。免疫グロブリンを除いて、他の血漿分画製剤は培養などによる代替医薬品も供給されており、原料血液の供給量と血液製剤の需要を含めたバランスによる連産効率を考慮することが必要。
動物由来の原薬
動物由来の原薬は、別項目で記載した”動物細胞培養原薬”、”血液製剤”などを除くと、化学合成や遺伝子工学の技術では製造が難しい成分を、主にウシやブタの内臓(小腸、膵臓、胎盤等)から抽出、精製してものであり、ヘパリンが有名である。動物由来の原薬は、原材料の安全性を担保することが重要であり、由来動物の飼育・と畜の状況などの記録が整備、保管させていなければならない。特に、牛海綿状脳症(BSE)をはじめとするプリオン病の対策がなされていることが必須である。
植物性医薬品
植物に含まれる化学成分を薬として活用するもので漢方薬、生薬などは古くから利用されている。ケシ由来の鎮痛薬モルヒネやヤナギ由来の鎮痛剤アスピリンなどがよく知られている。漢方薬は複数の生薬の決められた組合せ(方剤)にて用いられる。一般的な製造方法は、有効成分を含む部位の選別、乾燥、粉砕、抽出、濃縮、精製、調合、などの工程を組合せる。
高分子原薬 製造施設~建設のキーポイント~
製造施設の計画

高分子医薬の製造施設は、遺伝子組換え作業及びマスターセルバンク構築エリア、培養・精製エリア、製剤化エリアなどから構成される。各エリアとも細胞の汚染を防ぐために清浄な環境を維持すると共に、作業者の更衣、入退出の管理、材料の搬出入の管理、ハザード物質の管理を考慮した施設が必要となる。製造エリア内にはクリーンベンチ、セイフティーキャビネット、インキュベータ、遠心機、細胞培養装置、液体窒素保存容器などの細胞保存用機器、滅菌機器などが設置される。
スケールアップ

創薬段階から治験、上市に進む段階で、ビーカー→ベンチ(ここまでをまとめてキロラボと呼ぶことがある)→パイロット→ローンチ→コマーシャルとスケールアップしていく。この中でいかに製品品質、生産効率を確保するかがキーポイントとなる。実験室スケールから実生産レベルへのスケールアップは、反応槽の容量や時間を単純に拡大すれば解決するものではない。パラメータの設定法や計算式など基本的な考え方があるが、期待通りの収率が得られないことが多い。スケールアップの実験で試行錯誤していくことになる。(プロセス開発)スケールアップで検討するプロセス開発は、化学合成で作られる低分子原薬でも共通したことだが、細胞培養が伴う高分子原薬ではよりデリケートとなる。パイロットプラントなどでの検討を経て、商用生産の設備を建設することになるが、プロセス開発側からの要望を確実に反映した設備とすることが必要となる。
運転タイムスケジュール

培養原薬について、製造工程は大きく培養工程(上流)、精製工程(下流)に分けられる。培養工程は一つの装置(培養槽)で数日~1ヶ月程度継続して運転する一方で、精製工程は、各装置は通常1日の運転となる。稼働率を上げ、また装置を過剰な仕様にしないためには、通常精製1系統に対して培養は複数系統の組合せとなる。最適な設備設計・運用には、C/SIPやカラムの再生、平衡化の時間を含めた運転タイムスケジュールを組むことが必要となる。
C/SIP

定置洗浄(CIP)/定置滅菌(SIP)は製造設備を分解や移動をせずに洗浄及び滅菌を行うための設備。CIPは水もしくは酸やアルカリや界面活性を含む洗浄液で製造機器や配管の内面を洗浄する。機器内部の洗浄はスプレボールなどを使用してすべての面に洗浄液及びリンス水が散布され残留物質が除去されることが必要。配管の内面洗浄についても流速の確保やデッドスペースをなくすことで洗浄性を確保する。SIPは精製水を原水とした飽和蒸気(ピュアスチーム)を機器の内部や配管に通して系内を一定の温度まで昇温し滅菌を行う。製造設備を分解する方式に比べて定置式のC/SIPは再現性の高い洗浄と滅菌が期待できる反面、設備が複雑になりイニシャルコストが高くなる。
シングルユース技術

バイオ医薬品やワクチンはその製剤の特徴より、高い洗浄性および滅菌性が求められ、特に洗浄性に関しては、洗浄バリデーションを確立することに高いハードルがある。これらの製剤の早期立ち上げや多品種生産に対応するために、洗浄・滅菌が不要な単回使用のシングルユース製品を利用したシングルユース技術の採用が有効となる。簡単な調合設備から培養装置や撹拌機まで多様なシングルユース用の製品が供給されている。また、培養、精製、培地調整、pH調整、不活化、濾過、コネクターなどのシングルユースパートを組合せて、全体の工程の自動化を図った設備もある。従来より広い保管スペースが必要となることに留意が必要。シングルユース設備の無菌性、溶出性、完全性、工程間の接続方法などについては十分なリスクアセスメントを行うことが必要であるが、洗浄や滅菌に関連する設備が省略されるため生産設備の構築もより簡易にかつフレキシブルになるメリットがある。
連続生産
バイオ原薬の連続生産は、培地投入と培養液の抜出を連続的に行う連続培養(灌流培養・Perfusion Culture)と一工程に複数の小規模のカラムを利用し、負荷、洗浄、回収等を各カラムで同時に行う連続精製による。連続生産には、スケールアップが不要となることでの開発期間の削減や、機器の小型化とそれに伴う面積縮小などが期待され、ICHや各規制当局も導入を促進する動きを見せているが、バッチ生産と比較して管理戦略(State of Controlの)理解やロットの定義に考慮することが必要である。
シーエムプラスのつよみ
①エンジニアリング+CM方式
CM方式は、プロジェクトを成功に導くために、QCD(品質、コスト、工程)+EHS(環境、衛生、安全)の各々の観点で、発注者お客様、設計者と一体となって透明性を持って、プロジェクトを運営管理する方式です。マネジメントを専門に行うCMr(コンストラクション・マネジャー)を始めとするプロフェッショナルが、お客様の立場で業務を行います。
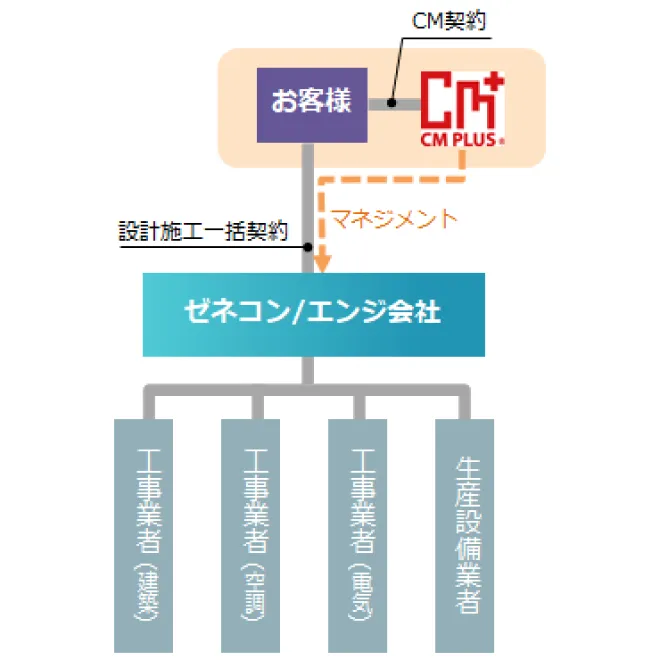
CM Plusでは、エンジニアリング(設計)を社内で行います。製造プロセス、機器・設備、建築並びに製造支援設備(電気・空調・ユーティリティ等)に精通したエンジニアを擁しており、計画初期段階から施設全体を俯瞰しますので、統合性のあるレイアウト施設の構築が可能です。
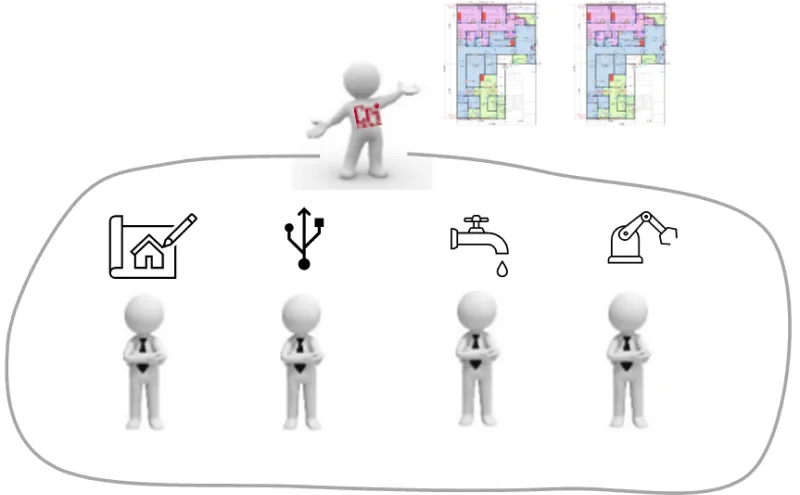
②生産機器と建築設備のトータルでの調整
生産機器のライン構築、レイアウトや内部動線/物流といった内面から建築設備を展開していくなど、生産プロセス中心の視点で設計を遂行していくため、生産システムと調和の採れた原薬工場を設計、建設します。又、生産システムのソフト面まで踏み込んだ計画を行います。
様々な分野での工場建設を経験したプロジェクトマネージャー、プロフェショナルエンジニアを擁しており、建物本体並びに製造支援設備はもちろんのこと、生産設備の購買サポート、製作管理、搬入計画の調整を含め、プロジェクトトータルでのスケジュール管理が可能です。

シーエムプラスの提供役務

事業構想
事業計画や投資計画の初期段階において、生産施設や物流施設の現状調査や改善の必要な事項の洗い出し、将来構想、設備の最適化の検討、投資コストの算出、費用対効果の検討、BCP検討、SDGsへの対応などをお客様のご希望に沿った形で実施します。
生産施設や物流施設の基本構想を行い、プロセスフローダイアグラム、メカニカルフローダイアグラム、マテリアルバランス、基本レイアウト、主要機器リスト、自動化計画、省エネ計画、設備稼働計画、人員配置計画などを作成し、投資イメージを可視化します。

基本計画
基本計画(概念設計)では、事業計画や投資計画の内容を理解して、施設への要求事項を分析・整理し、ユーザー要求概要書(URB)として文書化。また、URBの内容に基づきプロジェクト概算コストの算出や、プロジェクトの全体遂行計画の検討をお客様のニーズに沿った形で行います。

基本設計
基本設計ではURBの内容を確定し、必要な施設・設備の内容や容量を検討し、生産設備、物流設備、建築、ユーティリティ設備の仕様や配置など、特にプロセス設計ではPFD・P&ID・データシート・タイムスケジュール(OTS)・機器仕様書などを基本設計図書としてまとめます。また、施設の設計・建設に関連する法規基準や官庁申請、環境条件などを整理し、プロジェクトのマスタースケジュールや全体遂行計画の設定をサポートし、所轄官庁や電力・ユーティリティ供給会社等との事前調整の準備やサポートを行います。

見積引合い
機器類メーカーや工事施工会社の選定段階では、プロジェクトの全体遂行計画に従い、発注区分の検討や分離発注・一括発注の検討など最適な建設プロジェクトの遂行体制を確認をサポートし、また、引合い先選定、引合用図書の作成、見積の評価検討などをお客様の要望に沿った形で行います。

詳細設計・製作管理
詳細設計・製作段階では、設計事務所や工事施工会社、機器メーカーがURBや基本設計図書、関連法規基準を反映して設計を行っているか、スケジュール通り進捗しているかの観点で設計監理を行います。

施工・据付段階
機器類の製作や工事遂行段階では、機器メーカーや工事施工会社がURBや基本設計図書、関連法規基準を反映して機器類の製作や工事の実施を行っているかの観点で設計監理を行います。また、CM業務の場合には、全体スケジュールの進捗の確認、機器メーカー・施工業者間の相互の取合い調整の監理、プロジェクトの全体コストコントロールなどをお客様の要望に沿った形で実施します。

試運転
高品質かつ効率的なクオリフィケーション遂行のため、計画段階から、バリデーションマスタープラン作成やリスクアセスメントのサポート、クオリフィケーション(DQ,IQ,OQ,PQ)実施のためのプロトコル作成を行い、遂行段階の支援までお客様の要望に合った形でサービスを提供し、お客様の負担を軽減します。
施設稼働
関連コンテンツ
お役立ち情報
弊社の運営する情報発信サイト「GMP Platform」の原薬に関連する記事もぜひご参考ください。













