工場建設における基本計画(概念設計)
事業構想が固まったら、基本計画に移ります。
基本計画の段階では、工場の全体に係る考え方を設計していきます。
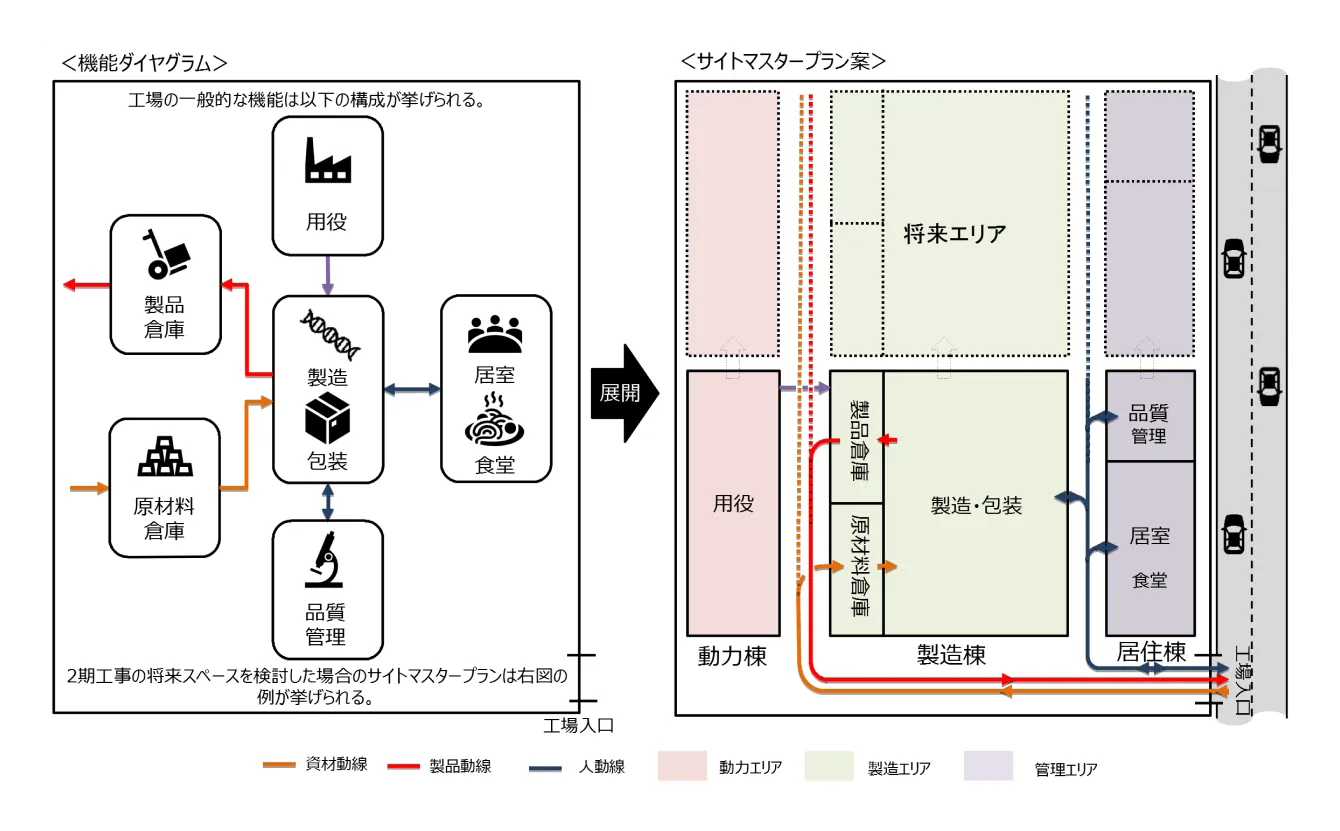
事業構想で挙げた基本要件に加え、工場のコンセプト、関連法規制リスト、社内規定リストを元として、生産量、生産品目等を具体化し、プロセスフロー、配置図、平面図を設計していきます。
基本計画の最後に、関係者全員がいる場でデザインレビューを行い、作成した設計図書が基本要件を満たしているかどうか確認します。
基本計画(概念設計)の流れ
コンセプト・
関連法規の整理
コンセプトの確認と規制の確認を行います。
中/長期計画と工場コンセプトの整合性確認
関連法規制のリストアップ および各法規の具体的な要求事項の確認
適用する社内基準のリストアップ および各基準の具体的な要求事項の確認
生産に関する条件の確認
生産に関する条件を具体的に設定し、プロセスフローを作成します。
生産量、生産品目、生産方法、操業計画、配員計画、物流計画等、生産に関する条件の具体化を行う。
生産方法(製造プロセス)について、原薬工場においてはプロセスフローダイアグラム(PFD)、製剤工場についてはマテリアルフローダイアグラム(MFD)を作成する。
建設コスト概算・
スケジュール修正
建設コストと建設スケジュールを概算し、評価・見直しをします。
基本設計に移行する前に、建設コストの概算を行い、このまま検討を進めてよいか判断します。類似案件から清浄度区分ごとに求めた面積単価と清浄度区分ごとの延床面積から建築コストを概算するなどの手法で算出します。建設スケジュールについても、より具体的な内容を検証し、2~3か月単位のスケジュールになるよう検討します。
デザインレビュー
デザインレビューを行い、最終調整を行います。
基本計画で作成した設計を、関係者を集めて様々な視点からレビューを行います。


基本計画(概念設計)のステップでは、工場建設における全体のフレーム設計をしていきます。また、この段階で人・物の導線を整理して基本機能を確認しつつ、法規制・ガイドラインを充足するような設計をしていくことがポイントになります。
成功のカギ
プロジェクトチーム構成 ~専門技術と全体統括~
工場は生産設備から建築設備、品質管理から安全管理と多岐にわたるため、様々な専門家の経験・知識を結集して進める必要があります。
一方で、各専門家の事情だけではなく、全体をプロジェクトチームとして組織し、プロジェクト全体の最適化を意識することも必要になります。ファシリテーターの技量が強く問われるところでもあります。
メンバーの認識共有
~ユーザー要求概要書(UR:User Requirement)の活用~
工場建設は大型投資になるため、関係者のそれぞれの立場からの意見が交錯し、議論が多く発生します。議論を進める過程で、核となる要求事項(ユーザー要求仕様:User Requirement)を文書化して共有することでメンバー間のイメージのずれを小さくしていくことが重要になります。
 さらに医薬品工場では…GMPへの意識
さらに医薬品工場では…GMPへの意識
GMPの要件は、基本計画の時点で盛り込んでおく必要があります。DQの時点で、設計からやり直しにならないよう、この時点でしっかりと確認することが望まれます。
-
クオリフィケーション・バリデーション活動についてはこちらを参考ください。
シーエムプラスでは…
お客様の会議運営をサポート

経験豊富なプロジェクトマネージャー(PMr)がお客様の会議運営をサポートします。予め工程表と成果物リストを明示し、計画に基づいて基本計画を進めていきます。シーエムプラスは専門性を持った第三者の立場で発言・アドバイスを行いますので、社内関係者の意見調整、プロジェクト推進力としてご活用ください。
ユーザー要求概要書(UR:User Requirement)の作成

お客様の工場に合わせた目次構成の文書を作成し、要求事項を文書化します。設計の経緯を議事録に残すだけでなく、1つの概要書にまとめることで、プロジェクトにおける要求事項や前提条件と最終設計成果物のつながりを俯瞰することができます。
 さらに医薬品工場では…GMPコンプライアンスアセスメント
さらに医薬品工場では…GMPコンプライアンスアセスメント

デザインレビューの一環として、動線や清浄度区分など工場における基本的要件がGMP基準を満たしているかどうかを評価し、記録に残します。最新のGMP要求事項に基づく独自の判定リストを用いて判断いたします。
URとは
User Requirement(or User Requirements Brief)の略号でユーザー要求(またはユーザー要求概要)と訳されます。
ISPEの書籍では、「製造される製品や、生産量(処理量)とその条件について、施設・設備への要求事項を記述したもの。」(C&Q)と定義されています。
URSとは
User Requirement Specificationの略号で「ユーザ要求仕様書」と訳されます。
ISPEの各書籍では、
- 「製品が製造される施設に関する要求事項、必要な処理量及び製品の製造環境条件に関する要件を説明した文書」(TT2)
- 「製造される製品や、生産量(処理量)とその条件について、施設/設備への要求事項を記述したもの。」(C&Q 水と蒸気)
などの表現で定義されています。
すなわち、URSとはユーザー要求(UR)を施設、システム、機器の設計や製作、建設に必要な仕様に展開したものとなります。
シーエムプラスは、ユーザーによって様々な形態となるユーザー要求(UR)を設計の担当者があらゆる手段を駆使してユーザーから聞き取り、URS項目に反映させることが重要であると考えます。
他のフェーズを詳しく見る
関連コンテンツ
お役立ち情報
弊社の運営する情報発信サイト「GMP Platform」の記事もぜひご参考ください。
タイトル「医薬品工場建設」に関わらず、その内容は医薬品工場に限定されないあらゆる業種の工場建設に適用できる内容となっています。

「医薬品工場建設のノウハウ」
医薬品工場建設プロジェクトの成功へのノウハウを集約。プロジェクト全体の計画(=プロジェクトの仕組みづくり)から、基本計画、基本設計などの各ステップの詳細とポイントを解説。

医薬品設備建設における「オーナーのプロジェクトマネジメント2nd改訂版」
オーナーの建設プロジェクトマネジメントについての連載5回目。基本計画(または概念設計)とは。