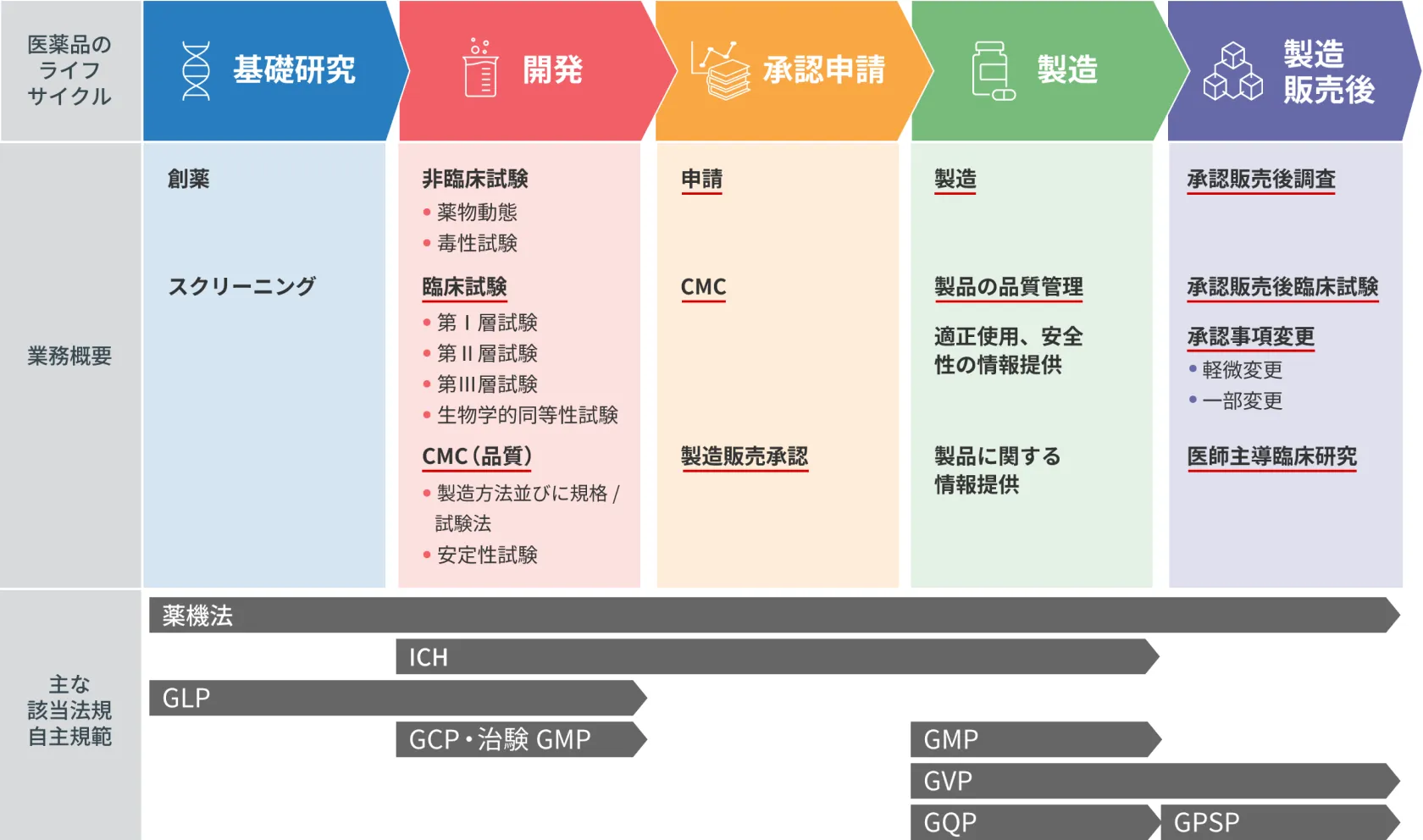
医薬品ライフサイクルと各ステップの業務
医薬品のライフサイクルにおける各ステップでは次のような業務が行われます。
- ※ 赤下線はシーエムプラスの薬事コンサルティングサービスの範囲を示します。
シーエムプラスの薬事コンサルティング
シーエムプラスの薬事コンサルティングは、製薬業界での実務経験の豊富な薬事コンサルタントがお客様のご要望に併せたコンサルティングサービスを提供します。
- 薬事申請戦略に関するコンサルティング
- GQP / GVP 等の社内体制構築コンサルティング
- 医薬品医療機器総合機構(PMDA)への各種相談に関する支援
- 医薬品等の製造販売業 / 製造業 / 外国製造業者認定等の申請支援(照会対応支援含む)
- 承認申請書および申請資料の作成支援
- 一部変更、軽微変更業務支援(照会対応支援含む)
シーエムプラスの薬事コンサルティングのつよみ
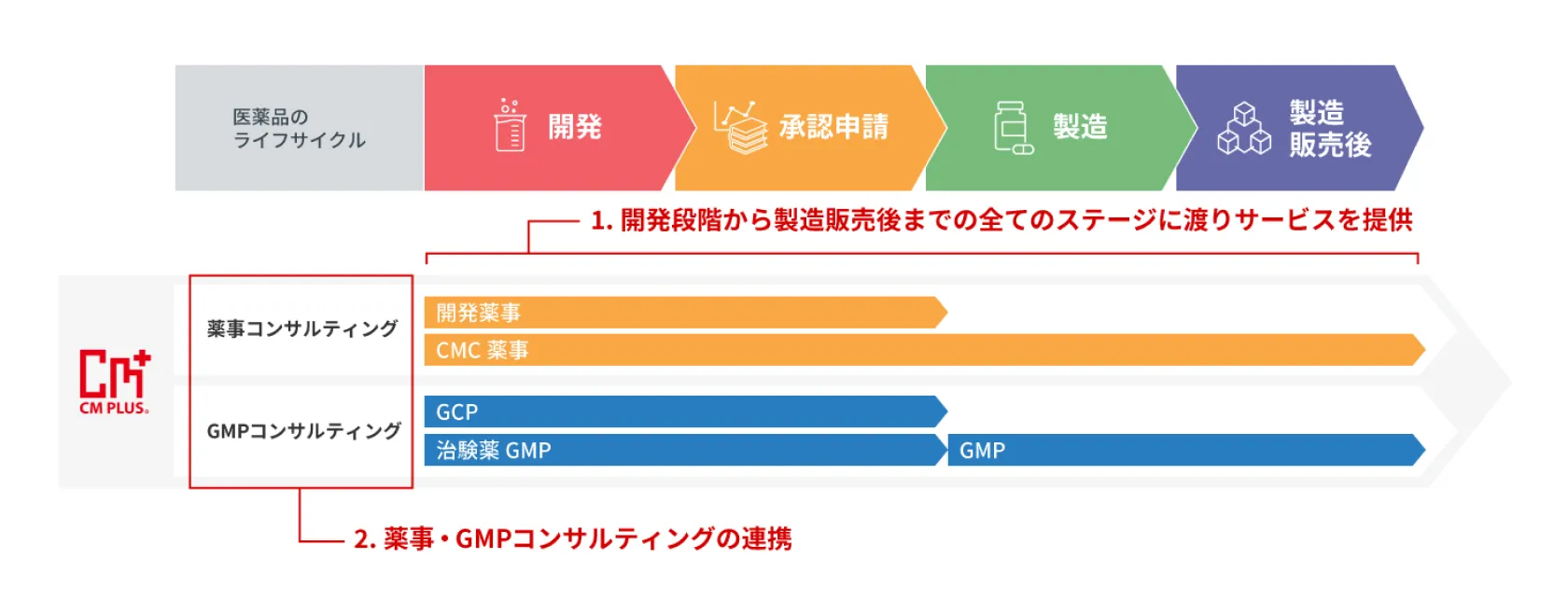
開発段階から製造販売後までの全てのステージでの薬事コンサルティングサービスを提供します。
シーエムプラスでは、開発・承認申請・製造・製造販売後まで全てのステージにおいて、製薬業界での実務経験豊富な薬事コンサルタントにより、開発薬事、CMC薬事、薬制薬事の観点からコンサルティングサービスを提供します。新医薬品、後発医薬品、再審査期間終了後の医薬品と医薬品種別を問わず、対応可能です。
GMPコンサルティングと連携した薬事コンサルティングサービスを提供します。
シーエムプラスでは、「GMPの製造部門、QAの品質保証部門の観点からのGMPコンサルティング」(現場対応)と「薬事面での解釈や書類等の手続きの観点からの薬事コンサルティング」(申請から照会対応までの規制当局との薬事対応)が可能で、両サービスを組み合わせることでより現場に即したGMP、QA、薬事面の連携コンサルティングサービスの提供が可能です。
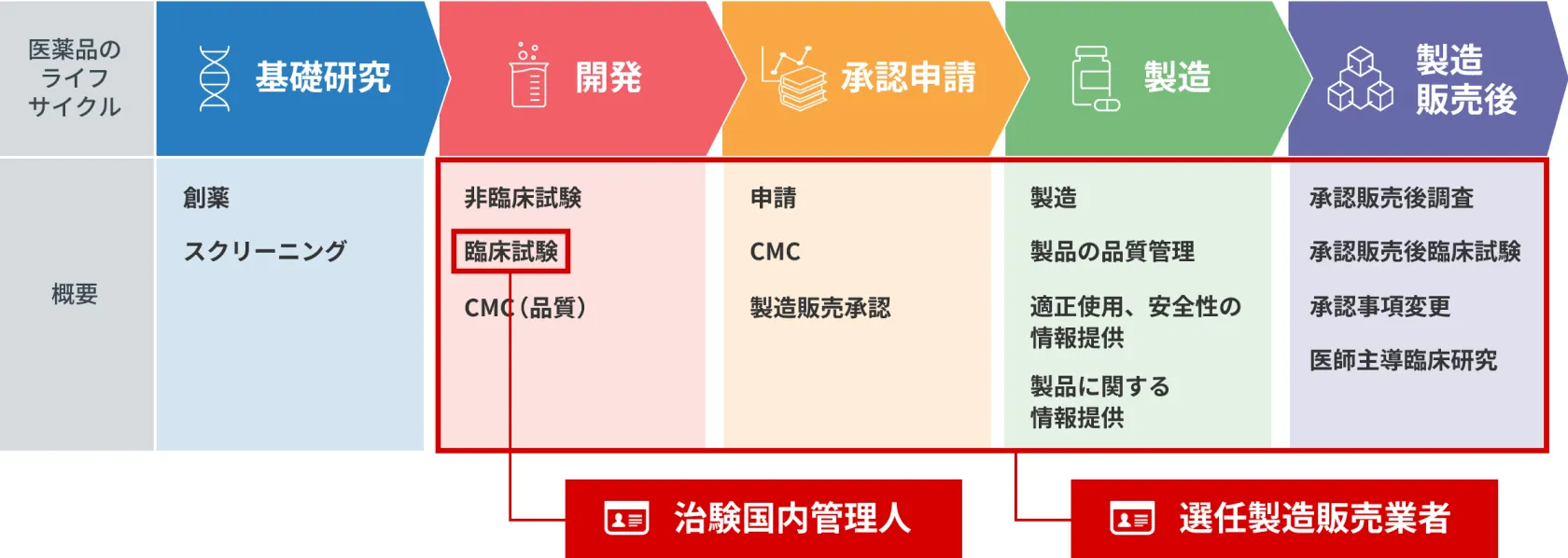
選任製造販売業者と治験国内管理人
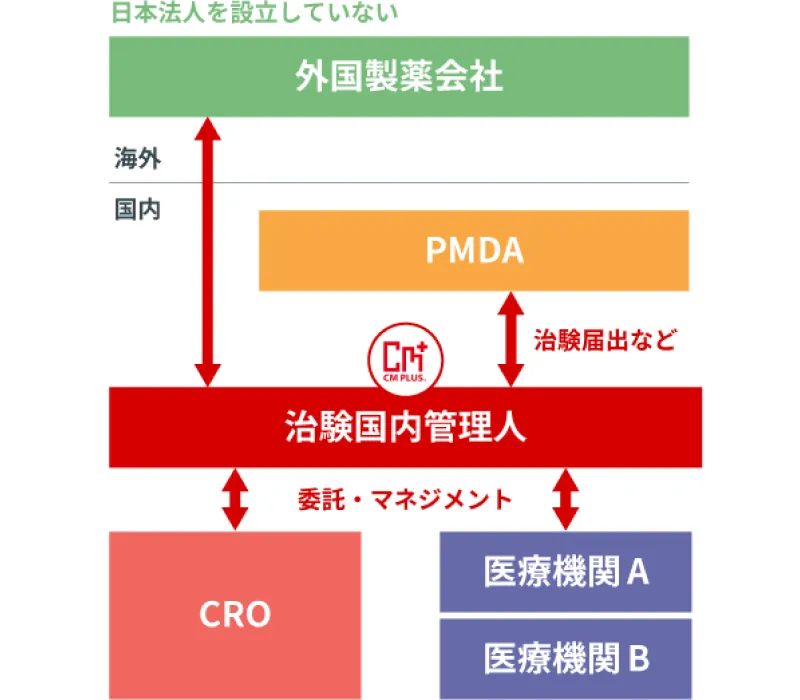
シーエムプラスは、第一種医薬品製造販売業並びに第二種医薬品製造販売業の業許可を取得しており、「日本の拠点」を持たない(日本国内に法人を設立していない)外国の製造業者に対し選任製造販売業者(DMAH)としてのサービスとともに治験国内管理人(ICCC:GCP省令第15条)として日本のGCP省令に適合した日本での臨床試験の運営サポート(日本国内で治験依頼者の役割)のみのサービスの提供も致します。
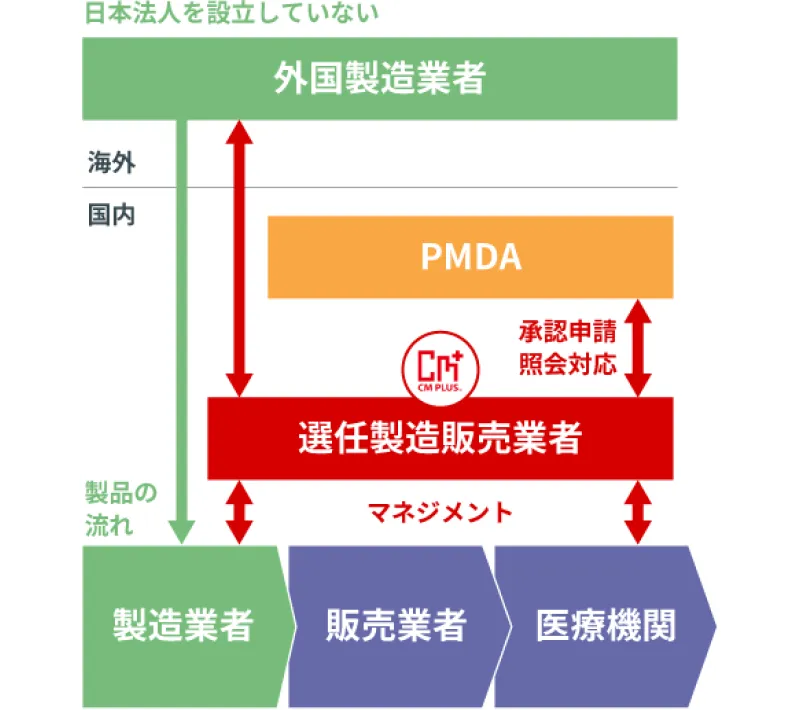
選任製造販売業者(D-MAH)サービス
外国製造業者による医薬品の日本市場へ主体的な参入を可能にするサービスです。
- ※ 選任製造販売業者(D-MAH:Designated Marketing Approval Holder)
日本法人を設立していない外国製造業者等が国内で医薬品及び医療機器等を販売する際には、製造販売業者1社を選任する必要があります。
シーエムプラスは、第1種医薬品製造販売業ならびに第2種医薬品製造販売業の業許可を取得しています。
日本市場へ参入、既参入外国製造業者及び輸入販売をお考えの国内製造業者向けに選任製造販売業としてサービスをご提供致します。
治験国内管理人(ICCC)サービス
日本法人を設立していない海外の医薬品企業(製薬会社や創薬ベンチャー等)に代わり日本国内での治験実施を可能とするサービスです。
- ※ 治験国内管理人(ICCC:In-Country Clinical Caretaker)
こんなお悩みはありませんか。
国内の企業様

異業種から医薬産業への参入を検討しており、製造販売承認の経験がなく、
どう進めていったらよいかわからない。


製薬業界での実務経験の豊富な薬事コンサルタントがお客様に寄り添い、ご要望に併せたコンサルティングサービスを提供します。また、シーエムプラスは、第一種医薬品製造販売業並びに第二種医薬品製造販売業の業許可を取得しております。

ベンチャー企業での初めての医薬開発のため、前臨床までの経験はあるが、開発ステージ以降の法規制が複雑で対応できない。


シーエムプラスは開発・承認申請・製造・製造販売後まで全てのステージにおいて、薬事コンサルティングサービスを提供します。また、トップクラスのGMPコンサルティングと連携対応が可能であり、薬事面からの支援からGMP、品質保証の面からの支援までのトータル支援サービスの提供も可能です。

PMDAへの相談を効果的に行い、開発期間を短縮したい。


PMDA相談の同席対応から相談後の開発戦略の助言アドバイスまで、PMDA相談に対する状況に応じたコンサルティングサービスの提供が可能です。製薬業界での実務経験豊富な薬事コンサルタントが対応いたします。

海外の工場に製造委託を検討しているが、必要な薬事手続きがわからない。


海外での製造所で製品を製造している場合、製品に関する製造販売申請の他にも、外国製造業者登録申請、GMP適合性調査申請など、外国製造業者との連絡を密にして膨大な情報を収集し、資料をまとめる必要があります。シーエムプラスでは外国製造業者との連絡・調整等のサービスの提供も可能です。

現在の申請内容から変更が発生するのですが、一部変更もしくは軽微変更の申請時アドバイスや申請書内容の薬事的側面からの事前確認対応等は依頼できるのでしょうか(国内のCROの業務内容にはない内容だと思いますが)。


製薬業界での実務経験豊富なCMC薬事のコンサルタントが在籍しておりますので、一変、軽微変更等の対応に関しても申請時(PMDAからの照会対応含む)の助言アドバイスから申請資料等の事前確認対応までの薬事コンサルティングの提供が可能です。
海外の企業様

日本法人を持っていなくても、製品の導出せずに、医薬品製造販売承認を取得できないか。


シーエムプラスは、第一種医薬品製造販売業ならびに第二種医薬品製造販売業の業許可を取得していますので、シーエムプラスを選任製造販売業者として選任いただくことで、外国特例承認申請が可能となり、日本での製品の製造販売承認申請が可能です。

日本に拠点がなくても、日本にて治験を実施できないか。


シーエムプラスを治験国内管理人として選任いただくことで必要に応じて国内での治験の実施が可能です。また、弊社には開発上市経験の豊富なスタッフが在籍しており、国内での治験実施体制(CRO、医療機関、検査機関)のご提案も可能であり、国内での治験を治験国内管理人として適切にサポートすることが可能です。