再生医療等製品とは 薬機法での分類
再生医療等製品とは、細胞や遺伝子を病気やケガの治療や予防に利用している製品です。医薬品医療機器等法(通称:薬機法)の中で定められている再生医療等製品の範囲は以下になります。
- 1.人又は動物の細胞に培養その他の加工を施したものであって、目的が
イ 人又は動物の身体の構造・機能の再建・修復・形成
ロ 人又は動物の疾病の治療・予防 - 2.人又は動物の疾病の治療を目的として、人又は動物の細胞に導入されて、
体内で発現する遺伝子を含有させたもの
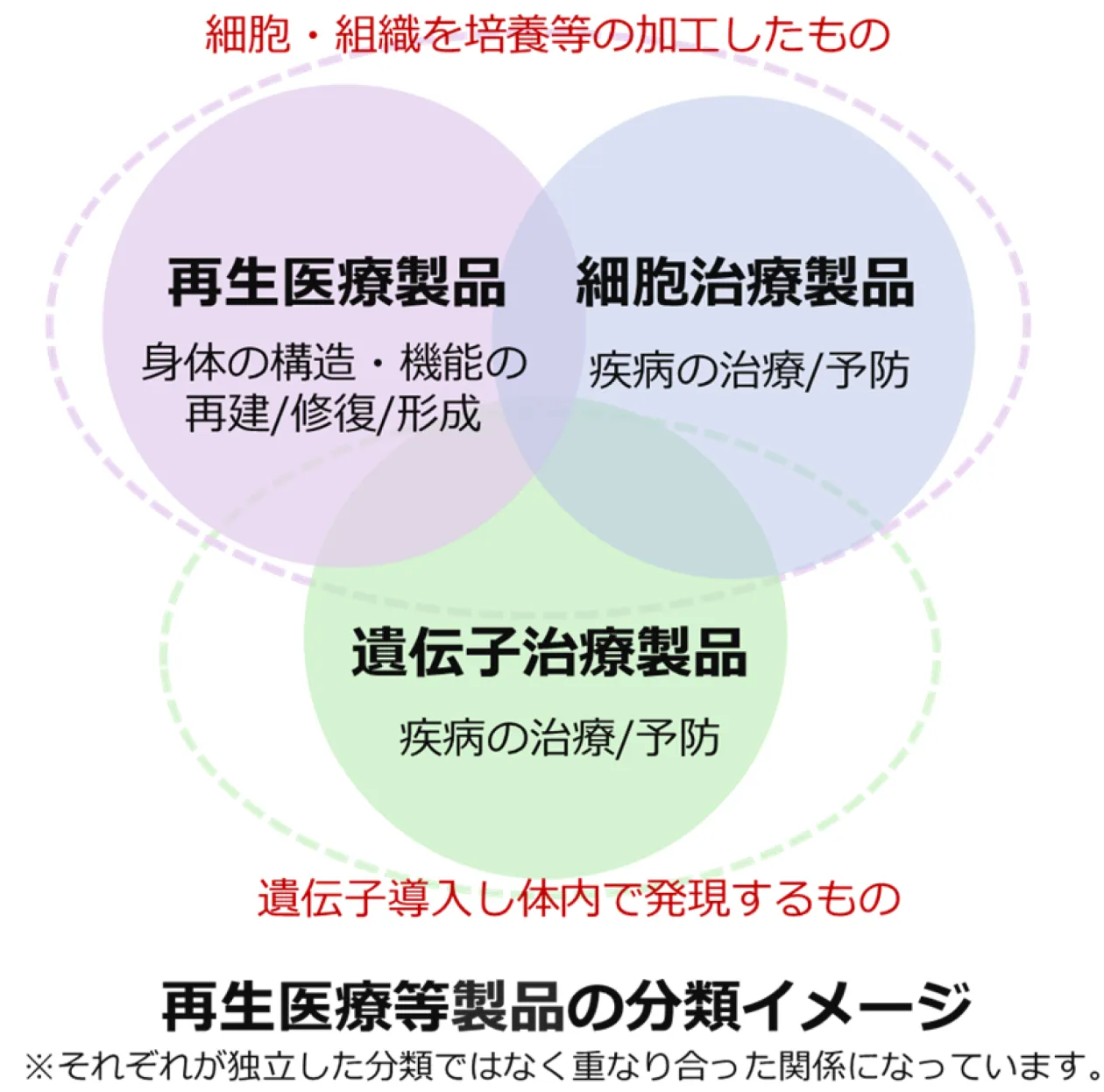
再生医療等製品は、医薬品医療機器等法(通称:薬機法)の中で医薬品や医療機器とは別に分類されています。再生医療等製品は生きた細胞やウィルスそのものを製品として扱うため、医薬品や医療機器とは異なる特殊な製造・品質管理が必要です。
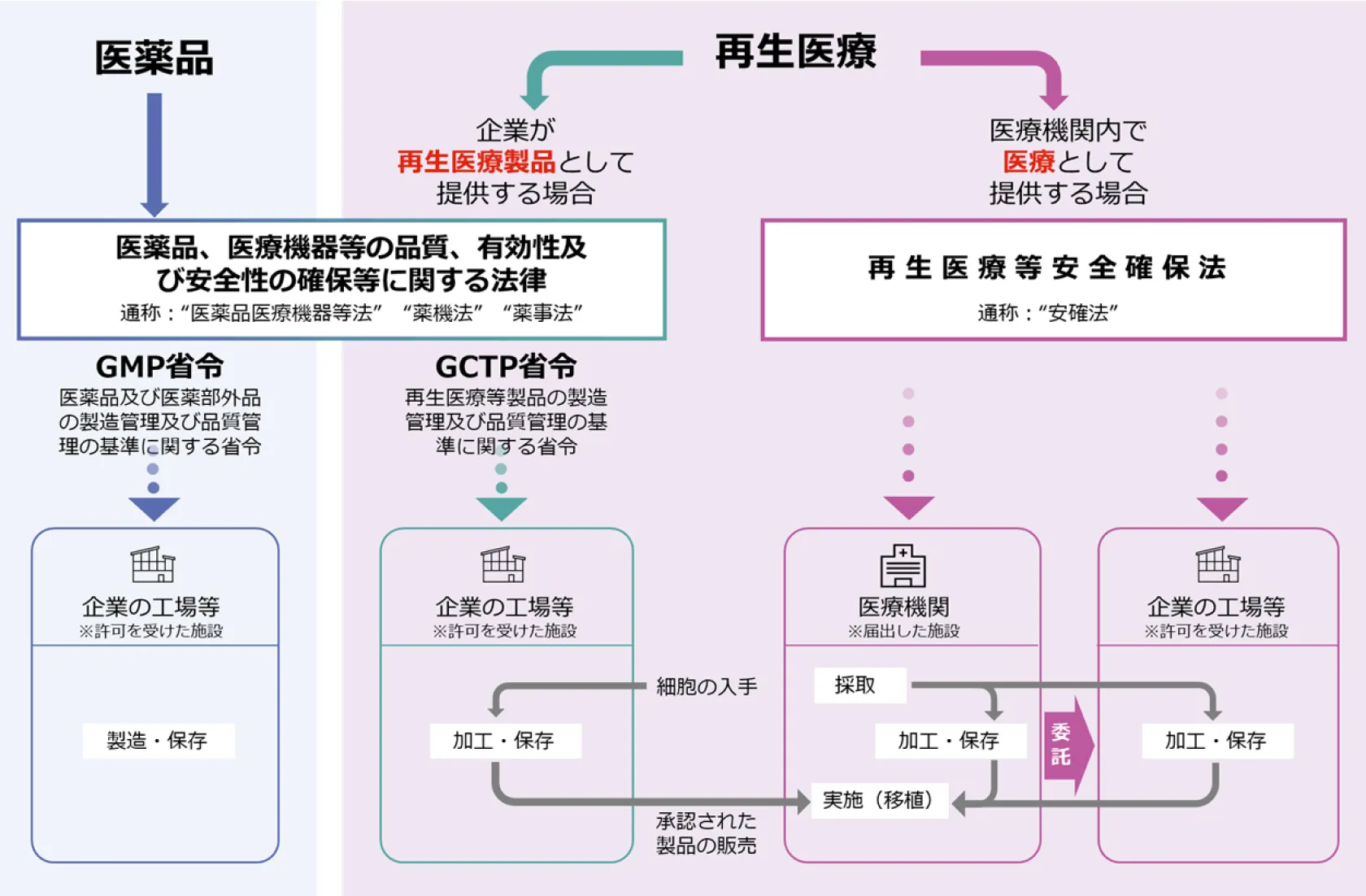
再生医療における"製品"と"医療"の違い
再生医療については、企業として再生医療製品を提供する場合と医療機関内で医療として提供する場合で適用される法規制が異なります。前者は医薬品医療機器等法の下、GCTP省令に適合した製造施設及び製造管理や品質管理を行う必要があります。一方、後者は再生医療等安全確保法が適用されることとなり、同法の下、臨床研究や自由診療を行う必要があります。
シーエムプラスの再生医療等支援
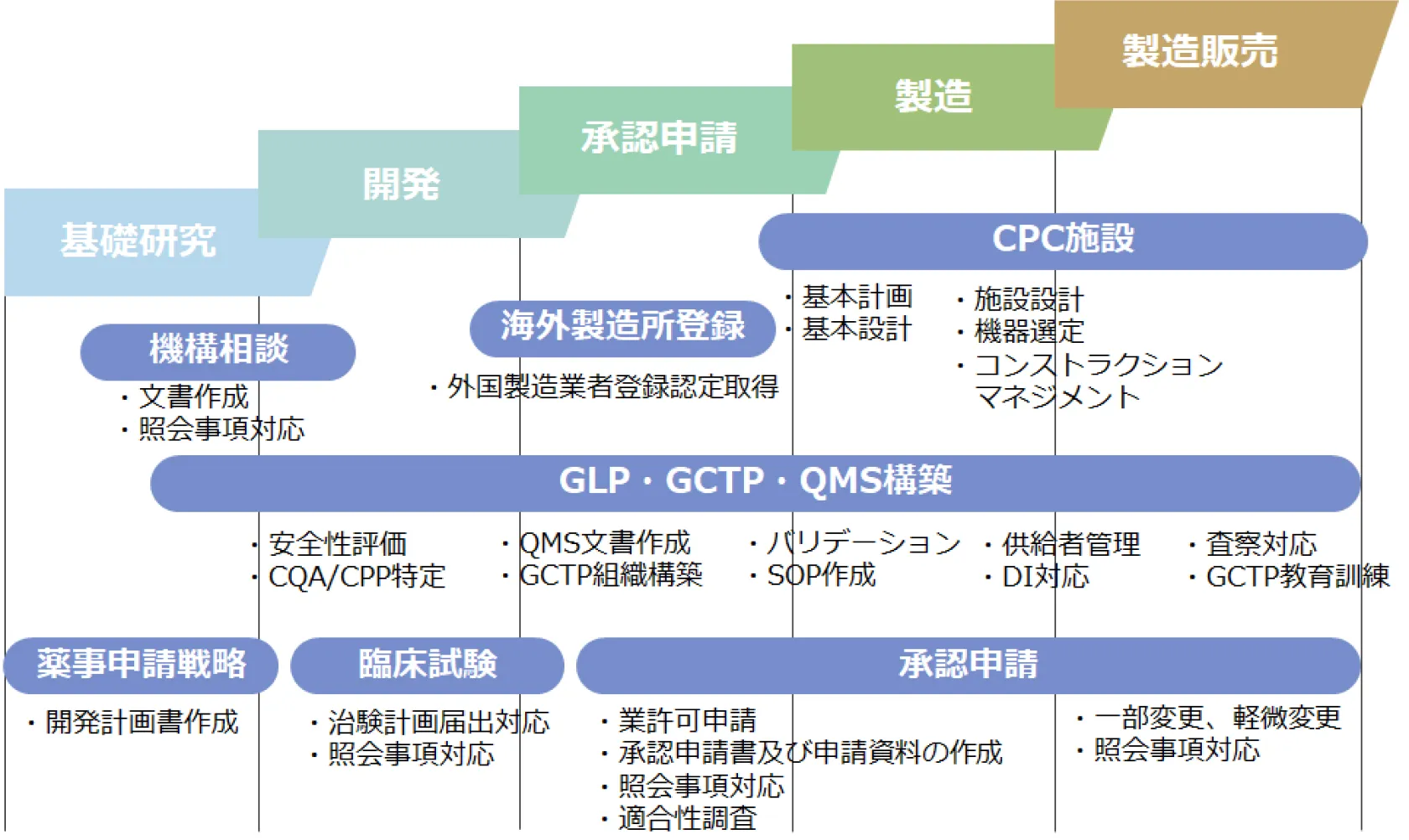
再生医療等製品の開発~製造・販売までのステップ
シーエムプラスでは、再生医療等製品の基礎研究から製造販売後まであらゆるフェーズでお客様をサポートさせていただきます。
こんなお悩みはありませんか。
- 異業種から再生医療産業への新規参入を検討したい。
- GCTPに対応した組織構築を行いたい。
- ラボから商業スケールに機器をスケールアップしたい。機器の選定や仕様決定を支援してほしい。
- 昨今のリスクベースドアプローチに対応したドキュメント作成を行いたい。
- CPC施設を自社で持つべきか、委託するべきか悩んでいる。
- 生産を行うにあたり、バリデーションやSOPを実施/作成しないといけないが、社内リソースが足りない。
- 自社の設備が最新の規制要件を満たしているか、GAP分析をしたい。
- 当局との事前相談や査察対応時に同行してほしい。
- レンタルラボを借りて設備を導入したいがGCTPに対応したレイアウトプランを検討したい。等

シーエムプラスにご相談ください。
- シーエムプラスでは様々な分野のコンサルタントが在籍しており、再生医療分野においても研究・開発フェーズの薬事申請戦略、GCTP組織構築から、製造フェーズのCPC施設計画までシーエムプラスではコンサルティングとエンジニアリングが連携し、ワンストップでお客様のご要望にお応えすることが可能です。
シーエムプラスの再生医療に対するワンストップサービス
実務経験の豊富な再生医療コンサルタント、エンジニアがお客様のご要望に併せたサービスを提供します。


薬事コンサルティング
開発計画作成支援、医薬品医療機器総合機構(PMDA)への各種相談に関する支援、医薬品等の製造販売業/製造業/外国製造業者認定等の支援(照会対応支援含む)、承認申請書および申請資料の作成、等

施設・設備診断/構築支援
CPC建設計画時の基本計画・基本設計等の施設設計支援、生産機器導入時の機器選定・仕様書作成支援、CPC建築時におけるコンストラクションマネジメント、等
- CPC:Cell Processing Centerの略(細胞培養加工施設) 海外ではCPF(Cell Processing Facility)とも呼ぶ。 細胞治療や再生医療に用いる特定細胞加工物を製造する施設で、 その稼働には厚生労働大臣に届け出をして施設番号が付与されていることが条件となります。


海外・外国語業務支援
海外工場建設プロジェクト支援、外国製造業者登録認定取得支援、海外監査における通訳者の派遣、ドキュメントの英文化作業支援、等
お悩みへの対応例①
(再生医療企業のお客様)

再生医療事業を立ち上げている。
おおまかなスケジュールは立てているが、製造販売承認、製造販売業許可、GCTP適合性確認、組織構築など何から手を付けて良いのか分からない。
このようなお悩みを持たれたお客様に対してシーエムプラスは以下のような支援をさせて頂くことが可能です。


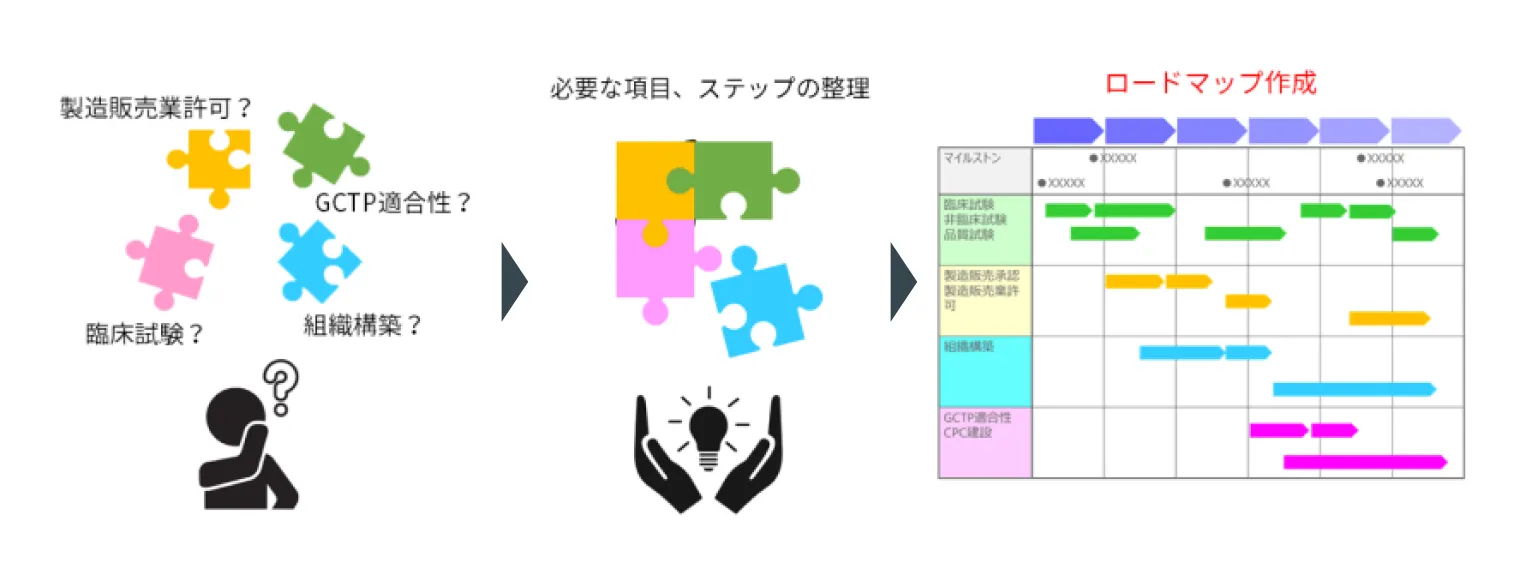
再生医療事業化計画・開発計画に対するロードマップ立案
再生医療事業の立ち上げにおいては、必要な手続きや調査事項が漏れなく網羅され、実施順序がよく練られたロードマップ(マスタースケジュール)が計画されていることが事業化成功の一つのカギです。しかし、このロードマップ作成には非常に高い専門性・経験が求められるため、薬事やQMSに対する知識、医薬品や再生医療分野の開発経験のある専門家の参画が不可欠です。シーエムプラスには再生医療分野の専門コンサルタントや薬事申請やQMS構築に詳しいコンサルタントが多数在籍しております。基礎研究・非臨床試験、臨床試験、品質試験、製造販売承認、製造販売業許可、GCTP適合性、外国製造業者認定など、各ステップを整理しロードマップの計画・立案を支援させて頂くことが可能です。

お悩みへの対応例②
(再生医療業界に参入を考えている装置メーカーや試薬メーカー等のお客様)

再生医療企業に対して当社の製品を売り込みたいがGCTPに対する知識が乏しく、再生医療企業からの供給者監査に対応できる自信がない。


GCTP教育・組織構築・模擬供給者監査の実施
再生医療の分野では、GCTP規制を遵守する必要があります。シーエムプラスでは、再生医療業界に関わる装置メーカーや試薬メーカー等のお客様に対してGCTP教育支援やGCTP規制に対応した組織構築コンサルティング等のサービスを行うことが可能です。また、再生医療企業様による供給者監査を想定した模擬供給者監査を実施し、GCTP適合チェック、GAP分析等を実施するサービスを提供させて頂くことが可能です。製品特性、GCTP、設備、等、様々な視点からのコンサルティングをシーエムプラスならではのワンストップサービスを実施させていただきます。


関連コンテンツ
お役立ち情報
弊社の運営する情報発信サイト「GMP Platform」の記事もぜひご参考ください。

「臨床現場の再生医療」連載

「再生医療等製品の品質保証についての雑感」連載
「再生医療系若手技術者のための製造文書作成術」連載
「再生医療・細胞治療製品展」 を開催します
弊社が運営するライフサイエンス企業向け情報発信プラットフォーム「 iVEXL 」では『再生医療・細胞治療製品展』を開催します。
情報収集にお気軽にお立ち寄りください。

再生医療・細胞治療製品の実用化を目指し、細胞培養をはじめとする受託サービス、装置・機器、保管・輸送など、各社の最新の技術・サービスを一堂に展示します。