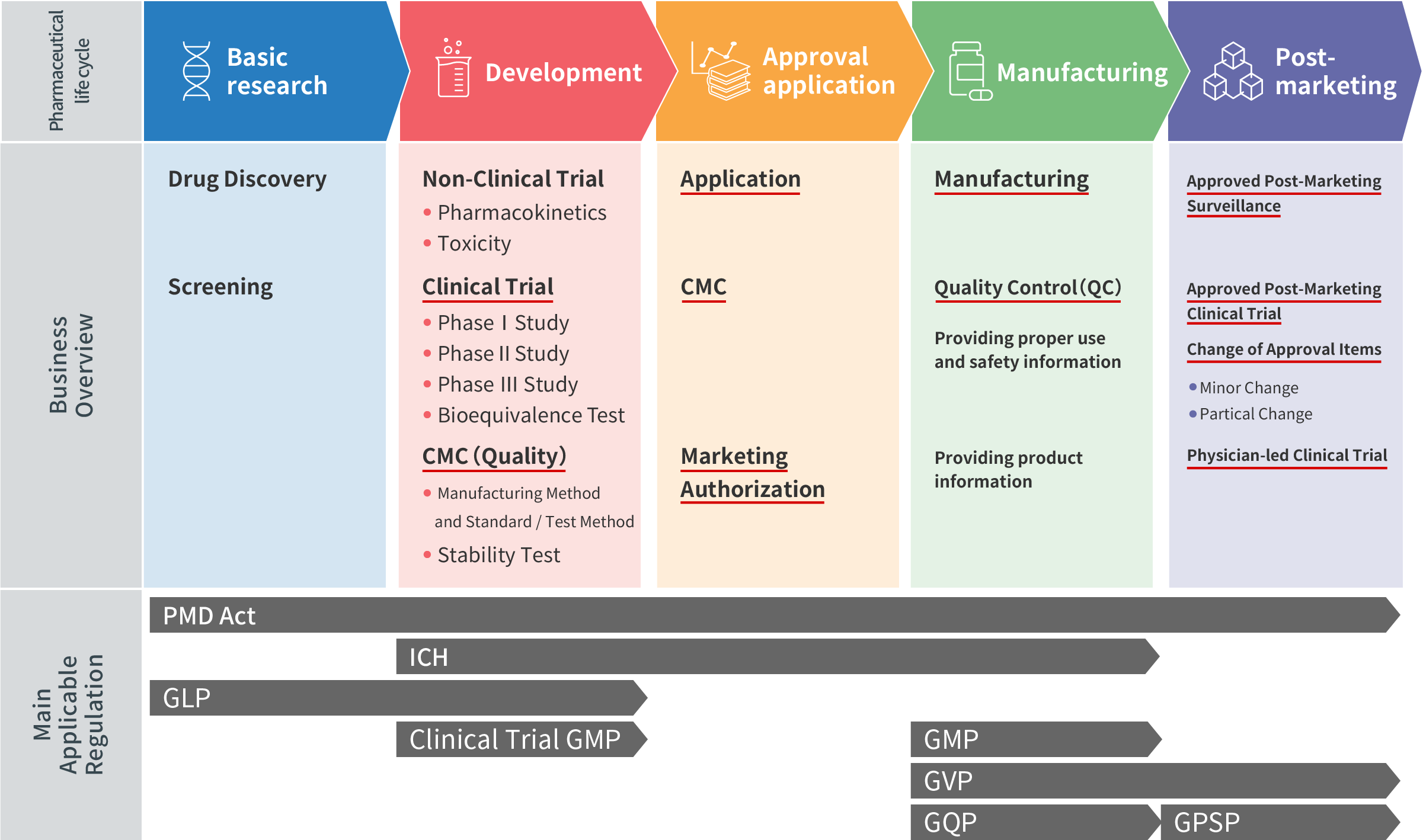
Vòng đời dược phẩm và nhiệm vụ từng bước
Từng bước trong vòng đời dược phẩm bao gồm các nhiệm vụ sau:
- * * Gạch chân màu đỏ cho biết phạm vi dịch vụ đăng ký của CM Plus.
Tư vấn đăng ký dược phẩm từ CM Plus
Các chuyên gia của chúng tôi cung cấp dịch vụ tư vấn đăng ký dược phẩm với kinh nghiệm thực tế phong phú trong ngành để đáp ứng nhu cầu của khách hàng.
- Chiến lược áp dụng quy định
- Xây dựng các hệ thống nội bộ như GQP / GVP
- Nhiều cuộc tham vấn khác nhau với Cơ quan Dược phẩm và Thiết bị y tế (PMDA)
- Hỗ trợ Giấy phép kinh doanh sản xuất/lưu hành cho các sản phẩm Dược phẩm, v.v./ Giấy phép kinh doanh sản xuất/ Đơn xin công nhận của các nhà sản xuất nước ngoài (bao gồm Hỗ trợ phản hồi yêu cầu)
- Hỗ trợ doanh nghiệp trong việc tạo Biểu mẫu Đơn xin phê duyệt và hồ sơ đăng ký
- Hỗ trợ doanh nghiệp trong việc Thay đổi một phần, Thay đổi nhỏ (bao gồm Hỗ trợ phản hồi yêu cầu)
Lợi ích của khách hàng từ dịch vụ tư vấn đăng ký dược phẩm CM Plus
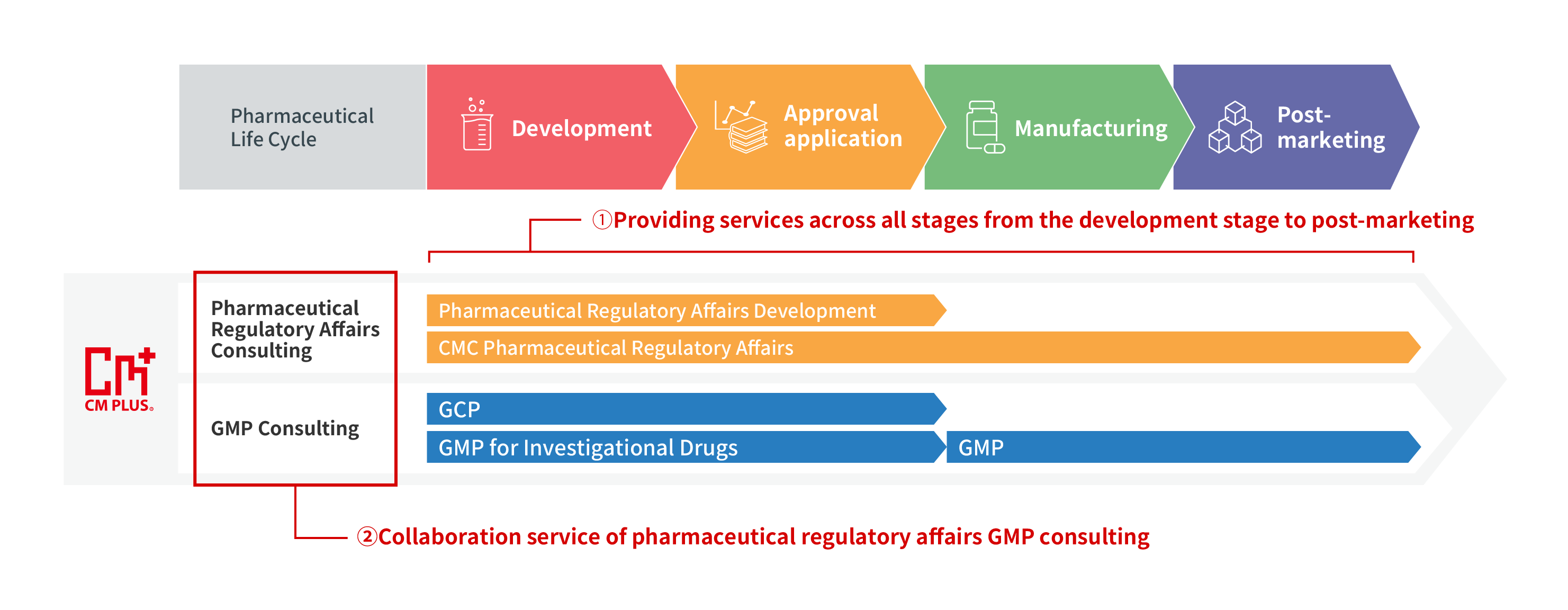
Dịch vụ tư vấn đăng ký ở mọi giai đoạn, từ phát triển đến sau khi đưa ra thị trường
CM Plus cung cấp các dịch vụ tư vấn về phát triển đăng ký, đăng ký CMC và đăng ký dược phẩm ở tất cả các giai đoạn, từ giai đoạn phát triển, nộp đơn xin phê duyệt, sản xuất đến sau khi đưa ra thị trường. WChúng tôi có thể xử lý các loại thuốc mới, thuốc gốc, thuốc đã được niêm yết lâu (sau thời gian kiểm tra lại) và nhiều loại thuốc khác nhau.
Dịch vụ tư vấn đăng ký phối hợp với dịch vụ tư vấn GMP.
CM Plus cung cấp hai dịch vụ. Dịch vụ đầu tiên là “Dịch vụ tư vấn GMP, theo quan điểm của bộ phận sản xuất GMP và đảm bảo chất lượng QA” (hỗ trợ tại chỗ). Dịch vụ thứ hai là “Dịch vụ tư vấn về đăng ký dược phẩm, theo quan điểm diễn giải quy định và quy trình tài liệu” (chúng tôi cung cấp dịch vụ tư vấn về phản hồi quy định cho các cơ quan quản lý, từ đơn đăng ký đến phản hồi yêu cầu). Kết hợp hai dịch vụ này cho phép chúng tôi cung cấp ccác dịch vụ tư vấn GMP, QA và đăng ký phối hợp được cho phù hợp hơn đối với cơ sở..
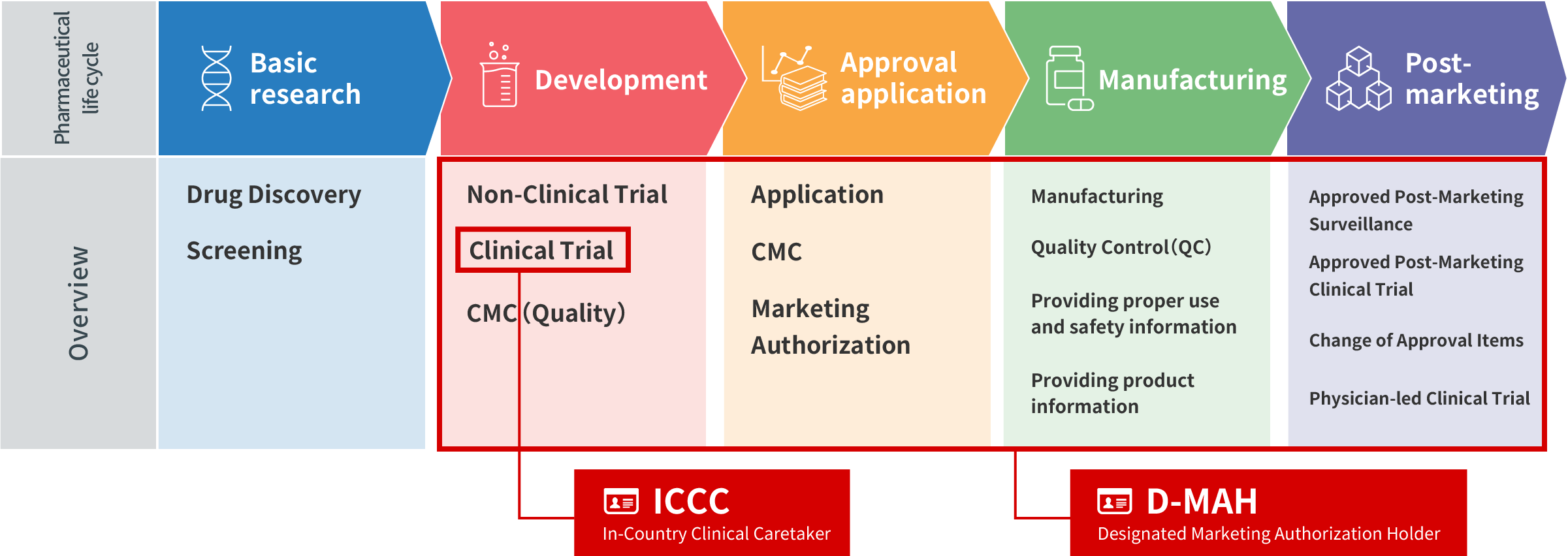
Chủ sở hữu giấy phép lưu hành được chỉ định
và Người chịu trách nhiệm thử nghiệm lâm sàng trong nước
CCM Plus đã có được giấy phép lưu hành hạng nhất và hạng hai cho thuốc. Chúng tôi có thể được chỉ định làm Người giữ giấy phép lưu hành được chỉ định (D-MAH) cho các công ty mà không có công ty nào được thành lập tại Nhật Bản. Chúng tôi cũng cung cấp dịch vụ hỗ trợ cho các thử nghiệm lâm sàng tại Nhật Bản tuân thủ theo Sắc lệnh của Bộ trưởng GCP Nhật Bản với tư cách là Người chịu trách nhiệm thử nghiệm lâm sàng trong nước (ICCC: Điều 15 trong Sắc lệnh của Bộ trưởng GCP) (vai trò tài trợ tại Nhật Bản)
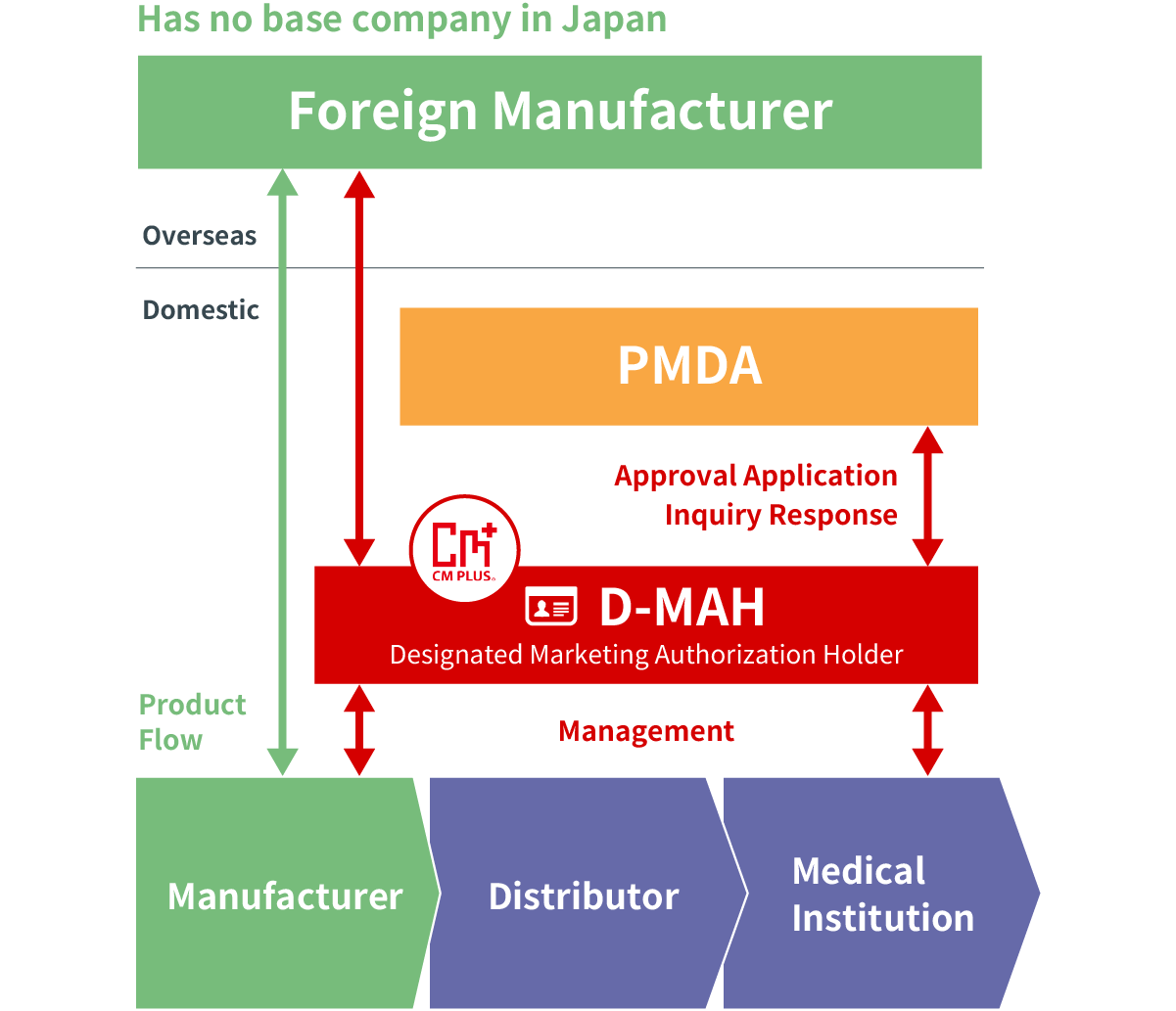
Dịch vụ Chủ sở hữu Giấy phép Lưu hành được Chỉ định (D-MAH)
Dịch vụ này cho phép các nhà sản xuất nước ngoài tự nguyện thâm nhập thị trường Nhật Bản đối với các sản phẩm dược phẩm.
Trong trường hợp một nhà sản xuất nước ngoài không có cơ sở kinh doanh tại Nhật Bản để bán dược phẩm và thiết bị y tế, cần phải chỉ định một chủ sở hữu giấy phép kinh doanh sản xuất/tiếp thị tại Nhật Bản.
CM Plus đã có được giấy phép lưu hành hạng nhất và hạng hai cho dược phẩm. Chúng tôi sẽ cung cấp dịch vụ với tư cách là Chủ sở hữu Giấy phép Lưu hành được Chỉ định (D-MAH) cho các nhà sản xuất nước ngoài đã thâm nhập thị trường Nhật Bản và cân nhắc nhập khẩu và bán.”
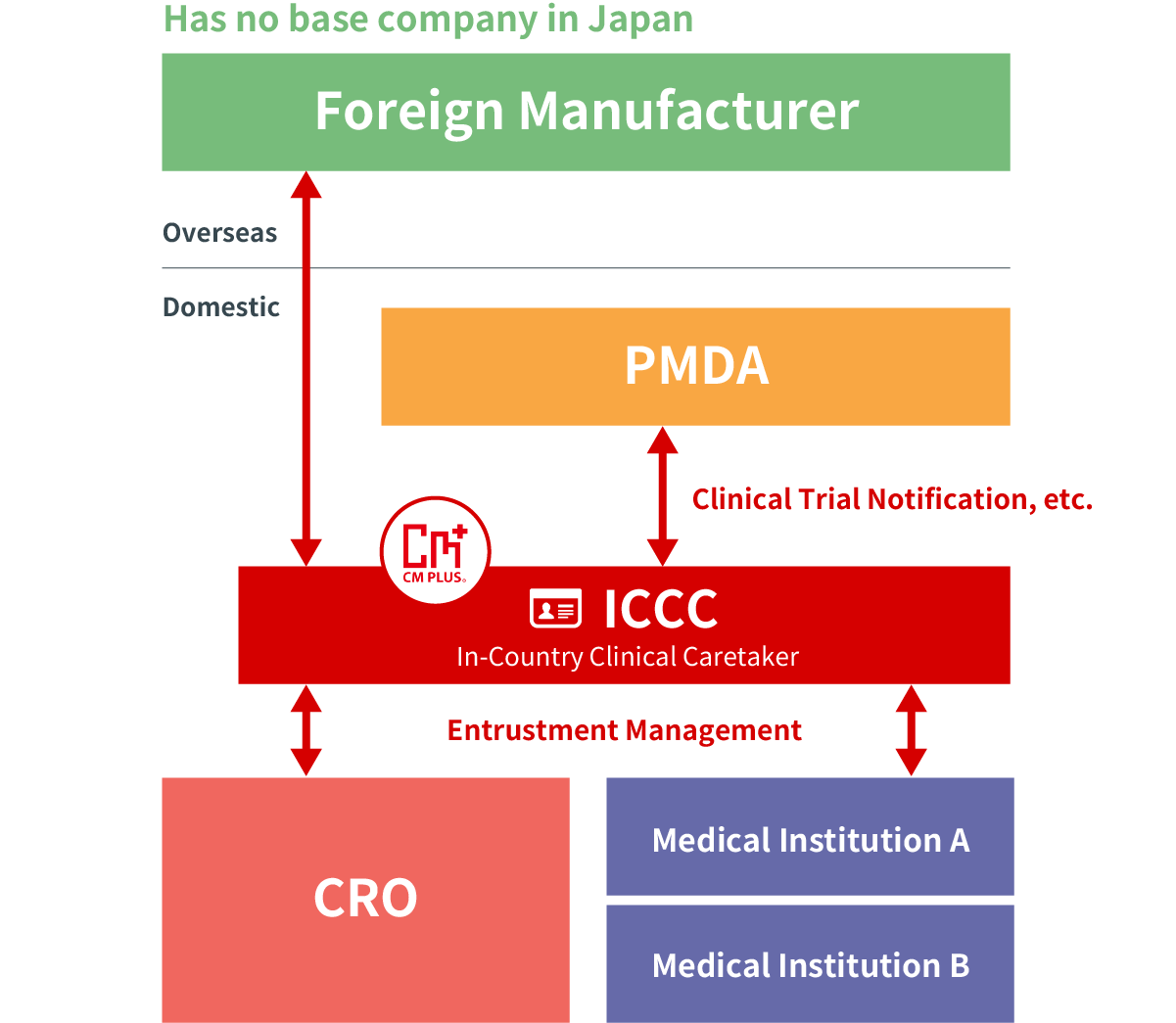
Dịch vụ chăm sóc lâm sàng trong nước (ICCC)
Dịch vụ này cho phép tiến hành thử nghiệm lâm sàng tại Nhật Bản thay mặt cho các công ty dược phẩm nước ngoài (công ty dược phẩm, liên doanh khám phá thuốc, v.v.) mà không cần pháp nhân.
Khi một công ty không có pháp nhân tại Nhật Bản tiến hành thử nghiệm lâm sàng tại Nhật Bản, cần phải ngăn ngừa sự xuất hiện hoặc lây lan các mối nguy hiểm cho sức khỏe do thuốc đang được nghiên cứu gây ra. Cần phải chỉ định một người có địa chỉ tại Nhật Bản làm người có thể yêu cầu thử nghiệm lâm sàng đại diện cho người đó.
Là đối tác phát triển lâm sàng, CM Plus sẽ đóng vai trò tài trợ tại Nhật Bản (ICCC: Điều 15 trong Sắc lệnh Bộ trưởng GCP) thay mặt cho một công ty dược phẩm không có cơ sở kinh doanh tại Nhật Bản)
Bạn có gặp phải các khó khăn sau không?
Đối với các công ty nước ngoài

Ngay cả khi công ty chúng tôi không có cơ sở kinh doanh tại Nhật Bản, chúng tôi vẫn có thể xin được phê duyệt sản xuất/lưu hành các sản phẩm dược phẩm mà không cần cấp phép sản phẩm ra bên ngoài không?


CM Plus đã xin được giấy phép kinh doanh cho giấy phép lưu hành hạng nhất và hạng hai cho dược phẩm. Việc chỉ định CM Plus là Người nắm giữ giấy phép lưu hành được chỉ định (D-MAH) giúp chúng tôi có thể nộp đơn xin phê duyệt đặc biệt của công ty nước ngoài. Bạn có thể sử dụng giấy phép này để nộp đơn xin phê duyệt lưu hành tại Nhật Bản.

Có thể tiến hành thử nghiệm lâm sàng tại Nhật Bản ngay cả khi không có công ty nào có trụ sở tại Nhật Bản không?


BBằng cách chỉ định CM Plus là Người chịu trách nhiệm thử nghiệm lâm sàng trong nước (ICCC), các thử nghiệm lâm sàng có thể được tiến hành tại Nhật Bản khi cần. Ngoài ra, chúng tôi có đội ngũ nhân viên có nhiều kinh nghiệm trong phát triển và tiếp thị, và CMP có thể đề xuất một hệ thống triển khai thử nghiệm lâm sàng (CRO, cơ sở y tế, cơ sở xét nghiệm) tại Nhật Bản.