Hỗ trợ Doanh Nghiệp Mới Gia Nhập Ngành Thiết Bị Y Tế
TQuy mô thị trường thiết bị y tế toàn cầu ước tính vào khoảng 30 nghìn tỷ yên, trong đó riêng Nhật Bản chiếm khoảng 2,8 nghìn tỷ yên.
Thị trường này lớn và hấp dẫn đối với những doanh nghiệp mới tham gia; tuy nhiên, các thiết bị y tế phải tuân theo các quy định nghiêm ngặt theo “Đạo luật đảm bảo chất lượng, hiệu quả và an toàn của sản phẩm bao gồm dược phẩm và thiết bị y tế” (viết tắt là Đạo luật dược phẩm và thiết bị y tế hoặc Đạo luật PMD). Ngay cả khi một vật liệu hoặc công nghệ có thể được ứng dụng vào y học thì vẫn còn nhiều rào cản đáng kể cần phải vượt qua để đưa nó ra thị trường như một thiết bị y tế.
CM Plus hỗ trợ doanh nghiệp mới tham gia bằng cách xây dựng hệ thống quản lý chất lượng (QMS) dựa trên Pháp lệnh QMS (ISO 13485) và tiến hành thiết kế và phát triển sản phẩm theo QMS ngay từ giai đoạn lập kế hoạch ban đầu của các thiết bị y tế, đảm bảo sự gia nhập thị trường suôn sẻ và không thể đảo ngược.
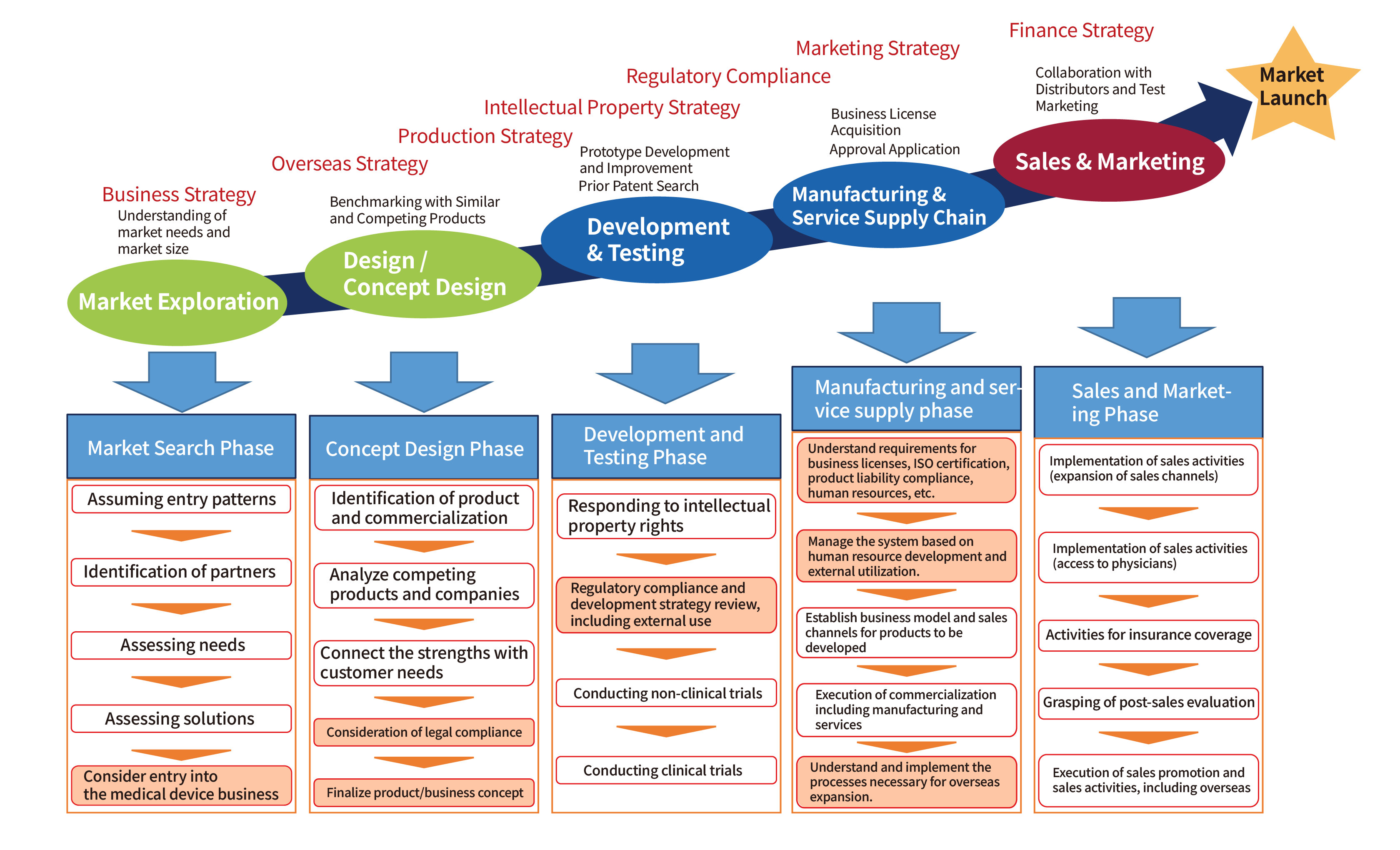
Lộ trình từ Phát triển đến Ra mắt Thị trường Thiết bị Y tế
“Sổ tay Hỗ trợ Phát triển Thiết bị Y tế” Đã sửa đổi vào tháng 10 năm 2023
Từ Văn phòng Nội các (Văn phòng Chiến lược Y tế và Chăm sóc Sức khỏe), Bộ Giáo dục, Văn hóa, Thể thao, Khoa học và Công nghệ, Bộ Y tế, Lao động và Phúc lợi, và Bộ Kinh tế, Thương mại và Công nghiệp
※chỉ ra phạm vi dịch vụ tư vấn thiết bị y tế của CM Plus.
Các Bước Triển Khai Điển Hình tại Nhật Bản
 Mua lại Giấy phép lưu hành thiết bị y tế và Đăng ký kinh doanh sản xuất
Mua lại Giấy phép lưu hành thiết bị y tế và Đăng ký kinh doanh sản xuất
Việc sản xuất và lưu hành thiết bị y tế tại Nhật Bản phải tuân thủ Đạo luật Dược phẩm và Thiết bị Y tế (Đạo luật PMD). Để tiến hành sản xuất và tiếp thị, cần phải có giấy phép lưu hành thiết bị y tế và để tiến hành sản xuất, cần phải đăng ký là doanh nghiệp sản xuất.
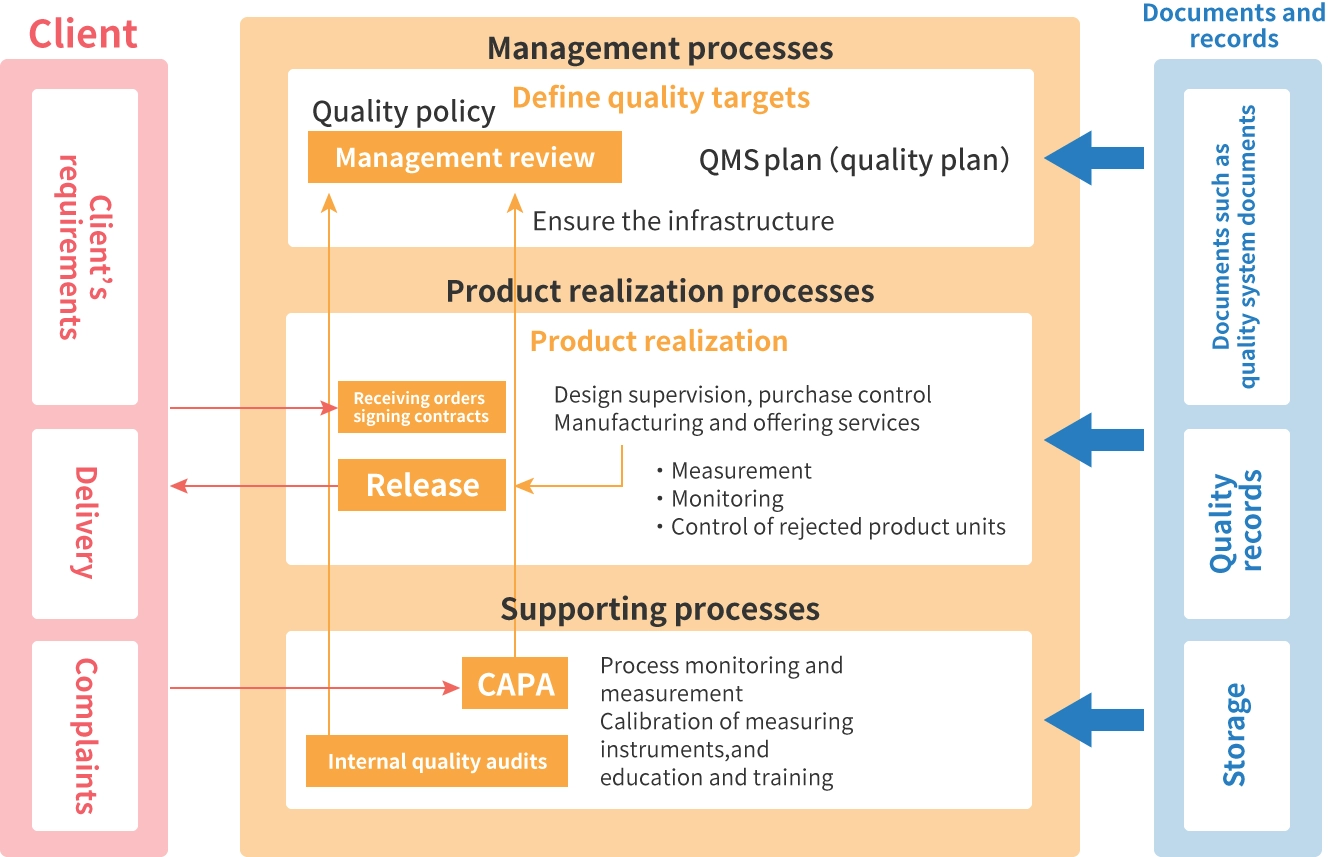
 Thiết lập QMS (Hệ thống quản lý chất lượng)
Thiết lập QMS (Hệ thống quản lý chất lượng)
Để thực hiện chuỗi quy trình thiết kế, phát triển, sản xuất, vận chuyển và bán các thiết bị y tế, yêu cầu phải có Hệ thống quản lý chất lượng (QMS) và trước tiên, QMS phải được thiết lập. Tại Nhật Bản, điều này được quy định trong Sắc lệnh số 169 của Bộ Y tế, Lao động và Phúc lợi (Sắc lệnh QMS). Sắc lệnh số 169 này phần lớn phù hợp với ISO 13485 (phiên bản 2016).
 Thông báo, Đơn xin cấp chứng nhận và Đơn xin phê duyệt cho Thiết bị y tế
Thông báo, Đơn xin cấp chứng nhận và Đơn xin phê duyệt cho Thiết bị y tế
Sau khi thiết kế, phát triển và sản xuất được chuẩn bị để thực hiện sản phẩm, cần phải thông báo, nộp đơn xin cấp chứng nhận hoặc đơn xin phê duyệt cho thiết bị y tế. Việc lựa chọn trong số những điều này phụ thuộc vào mức độ rủi ro liên quan đến thiết bị y tế.
Ví dụ, ống tiêm không có kim được phân loại là Loại I và cần phải thông báo, trong khi ống tiêm có kim được phân loại là Loại II và cần phải nộp đơn xin cấp chứng nhận. Ngoài ra, các thiết bị như ống thông được đưa vào mạch máu cần phải nộp đơn xin phê duyệt.
 Đánh giá sự phù hợp của QMS
Đánh giá sự phù hợp của QMS
Trong trường hợp đơn xin cấp chứng nhận hoặc đơn xin phê duyệt, đánh giá sự phù hợp của QMS sẽ được tiến hành sau khi đơn được nộp. Đánh giá này xác định liệu các hoạt động quản lý sản xuất và quản lý chất lượng có thực sự được triển khai theo đúng Pháp lệnh QMS và ISO 13485 (phiên bản 2016) hay không. Đối với chứng nhận, đánh giá này được thực hiện bởi Cơ quan chứng nhận đã đăng ký và đối với các sản phẩm được phê duyệt, đánh giá này được thực hiện bởi PMDA (Cơ quan dược phẩm và thiết bị y tế).
 Giấy phép lưu hành
Giấy phép lưu hành
Trong trường hợp các đơn xin cấp chứng nhận và phê duyệt, việc sản xuất và tiếp thị chỉ có thể thực hiện được sau khi đơn đã được thông qua và đánh giá sự phù hợp của QMS đã hoàn tất thành công.
Dịch Vụ Hỗ Trợ Gia Nhập Thị Trường Mới của CM Plus
Như đã trình bày trong các ví dụ trên, nhiều nhiệm vụ khác nhau phát sinh dựa trên các yêu cầu theo quy định trong các bước thâm nhập thị trường mới. CM Plus hỗ trợ thực hiện các nhiệm vụ này. Chúng tôi cung cấp các dịch vụ đáp ứng nhu cầu của bạn, từ hỗ trợ toàn bộ dự án đến hỗ trợ một phần, chẳng hạn như chỉ thẩm định. Nội dung hỗ trợ cụ thể như sau:
Thiết lập QMS
Chúng tôi hỗ trợ thiết lập Hệ thống quản lý chất lượng (QMS) càng nhỏ gọn càng tốt, phù hợp với quy mô hoạt động của bạn. Điều này bao gồm hỗ trợ chuẩn bị tài liệu cần thiết và triển khai thực tế hệ thống.

Hỗ trợ Kiểm soát Thiết kế
Chúng tôi hỗ trợ thiết kế các thiết bị y tế mới phát triển bằng cách giúp làm rõ các yêu cầu, chuyển đổi chúng thành dữ liệu đầu vào, tiến hành công việc thiết kế và phát triển thực tế, tạo ra đầu ra, xác minh đầu ra, thẩm định đầu ra và thực hiện các nhiệm vụ quản lý rủi ro tại các thời điểm quan trọng.

Hỗ Trợ Đáp ứng tiêu chuẩn Hệ Thống Quản Lý Chất Lượng (QMS)
Chúng tôi cung cấp hỗ trợ cho công tác chuẩn bị và các dịch vụ như kiểm tra giả định để chuẩn bị cho các cuộc kiểm tra của các tổ chức chứng nhận và PMDA.

Hỗ trợ Thẩm định
Khi thiết lập quy trình sản xuất tại cơ sở sản xuất, chúng tôi cung cấp hỗ trợ toàn diện, từ việc lập kế hoạch thẩm định đến tóm tắt báo cáo.

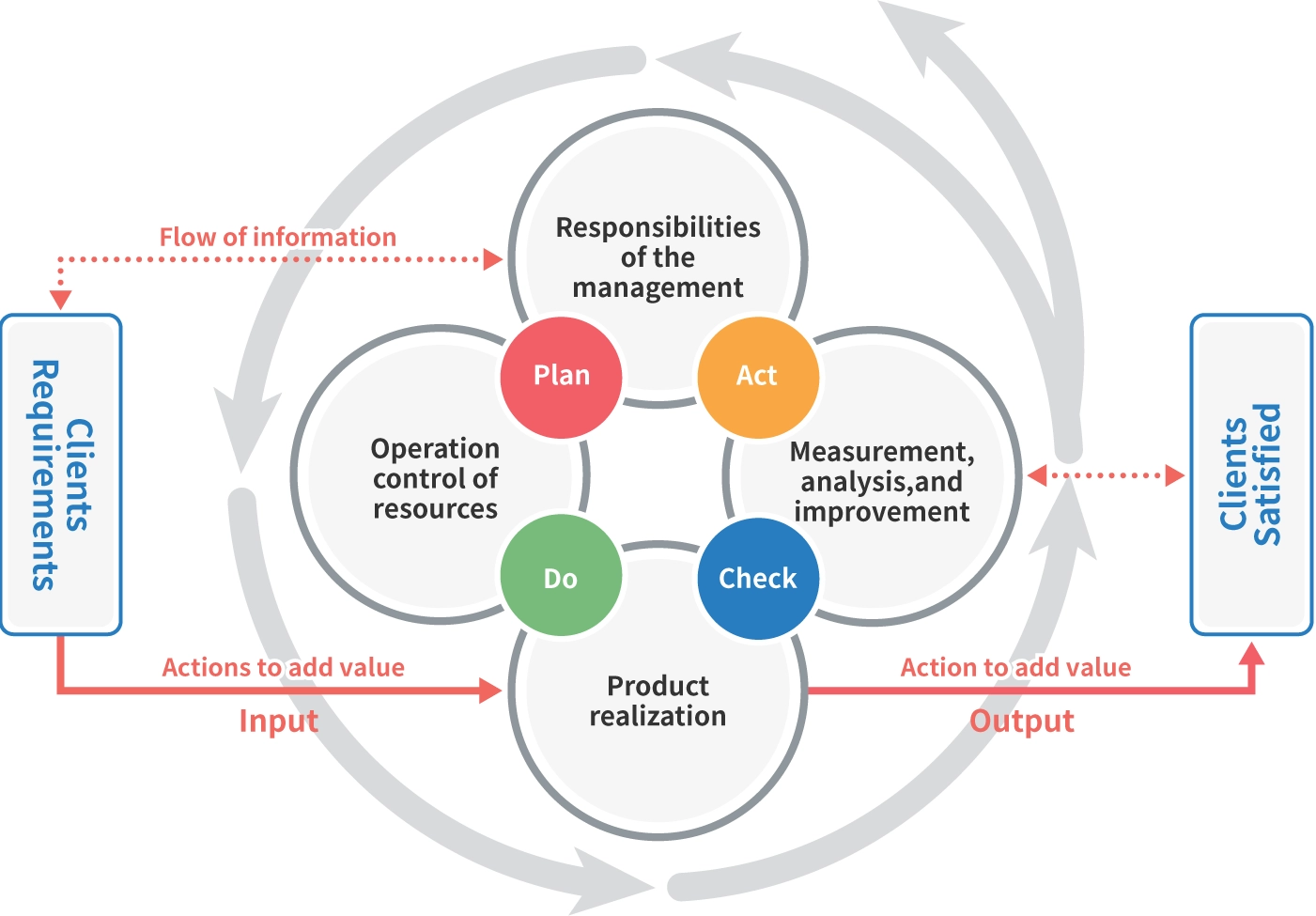
Hệ thống quản lý chất lượng: Cải tiến liên tục QMS
Thiết bị y tế là công cụ để điều trị và chẩn đoán, đòi hỏi phải cải tiến hiệu suất liên tục, tăng cường an toàn và cải tiến liên tục Hệ thống quản lý chất lượng (QMS). Để hỗ trợ cải tiến liên tục này, CM Plus cung cấp các dịch vụ sau.
Ngoài ra, nhiều nhà sản xuất thiết bị y tế không chỉ nhắm tới thị trường trong nước mà còn xuất khẩu sang nhiều nước trên thế giới. Các yêu cầu về quy định không chỉ bao gồm các quy định về QMS của Nhật Bản mà còn bao gồm các tiêu chuẩn quốc tế như ISO 13485 và Quy định về hệ thống chất lượng (QSR) của FDA Hoa Kỳ. Việc xuất khẩu đòi hỏi phải tuân thủ các quy định của quốc gia đó.
Cải tiến liên tục hệ thống quản lý chất lượng
Tối ưu hóa Hệ thống quản lý chất lượng (QMS)
Chúng tôi thường thấy những trường hợp mà bản thân Hệ thống quản lý chất lượng trở nên cồng kềnh và khó quản lý, biến thành một núi tài liệu do phải sửa chữa nhiều lần các vấn đề được nêu trong các cuộc thanh tra định kỳ ISO 13485 trước đây. Chúng tôi hỗ trợ việc tái thiết Hệ thống quản lý chất lượng nhỏ gọn và dễ vận hành dựa trên chu trình PDCA, phù hợp với quy mô của cơ sở sản xuất và số lượng mặt hàng được sản xuất hoặc bán ra.
Hỗ trợ xây dựng Hệ thống Đánh giá Quản lý
Cốt lõi của QMS là đánh giá quản lý mà ban quản lý cấp cao trực tiếp tham gia. CM Plus giúp tối ưu hóa nội dung đánh giá quản lý và định dạng của chúng để giúp ban quản lý cấp cao dễ dàng đưa ra quyết định hơn.
Hỗ trợ Đánh giá Hệ thống Hành động Khắc phục và Phòng ngừa
Các vấn đề thường được chỉ ra nhất trong các cuộc thanh tra QMS bên ngoài liên quan đến các hành động khắc phục và phòng ngừa. Hành động khắc phục thực sự là gì? Các phương pháp hiệu quả cho các hành động phòng ngừa là gì? Từ những góc nhìn này, chúng tôi đề xuất đánh giá hệ thống hiện tại.
Hỗ trợ kiểm soát thiết kế
Khi thiết kế các thiết bị y tế mới, CM Plus hỗ trợ các nội dung sau:
- Làm rõ các yêu cầu
- Chuyển đổi thành dữ liệu đầu vào
- Tiến trình công việc thiết kế và phát triển thực tế
- Tạo đầu ra
- Xác minh đầu ra
- Thẩm định đầu ra
- Quản lý rủi ro tại các điểm quan trọng
Ngoài ra, CM Plus cung cấp hỗ trợ toàn diện cho việc lập tài liệu, từ việc tạo đề cương dựa trên chu trình PDCA đến việc chuẩn bị báo cáo.
Hỗ trợ CSV (Thẩm định hệ thống máy tính)
Với sự tích hợp phần mềm vào các thiết bị y tế, việc bán phần mềm độc lập và việc sử dụng phần mềm chuyên dụng trong Hệ thống quản lý chất lượng, CSV (Thẩm định hệ thống máy tính) hiện là điều không thể thiếu. Chúng tôi hỗ trợ toàn bộ quy trình, từ lập kế hoạch CSV đến tạo báo cáo.
Hỗ trợ chuẩn bị cho Thanh tra tuân thủ QMS
Chúng tôi cung cấp các dịch vụ hỗ trợ chuẩn bị trước cho các cuộc thanh tra tuân thủ QMS của các tổ chức chứng nhận và PMDA, bao gồm cả các cuộc thanh tra giả định.
Hỗ trợ Thẩm định
Khi thiết lập quy trình sản xuất tại các cơ sở sản xuất, chúng tôi cung cấp hỗ trợ toàn diện cho việc thẩm định, từ khâu lập kế hoạch đến khâu biên soạn báo cáo. Các dịch vụ của chúng tôi đặc biệt bao gồm thẩm định các tiện ích liên quan cho quy trình khử trùng.
Để thẩm định nhà máy sản xuất và thiết bị xây dựng, vui lòng xem chi tiết tại đây.
CM Plus còn cung cấp dịch vụ tư vấn dược phẩm và có khả năng xử lý các sản phẩm kết hợp (dược phẩm + thiết bị y tế).
Tư vấn GMP/GDP dược phẩm
Cải tiến GMP/GDP, hỗ trợ kiểm tra, đào tạo GMP/GDP, hỗ trợ quản lý nhà cung cấp/quản lý mua hàng và các dịch vụ hỗ trợ M&A khác.
Giới thiệu về Dịch vụ học trực tuyến
“Khóa học thực hành về QMS thiết bị y tế theo ISO 13485:2016”
Chúng tôi cung cấp đào tạo trực tuyến về ISO 13485.
Các điểm chính của Khóa học thực hành về QMS thiết bị y tế
Khóa học này phản hồi bản sửa đổi năm 2016 của ISO 13485, bao gồm các nội dung thiết yếu theo yêu cầu của ISO 13485 đồng thời giải thích cả “những thay đổi trong các quy định được sửa đổi năm 2016” và “các triển khai thực tế cụ thể”.
“Bình luận về Sơ đồ quy trình Hệ thống quản lý chất lượng”
(Trích từ khóa học trực tuyến của chúng tôi, “Khóa đào tạo hướng thực hành về QMS cho thiết bị y tế theo ISO 13485: Phiên bản 2.” Hệ thống quản lý chất lượng)